
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Thermos heißt im Griechischen die Wärme. Nach diesem Worte hat der Erfinder einer neuen, besondere Wärmewirkungen erzeugenden Chemie, der Dr. Hans Goldschmidt, die neue Bezeichnung Thermit für eine ganze Reihe chemischer Mischungen gebildet, die eben imstande sind, solche Wärmewirkungen hervorzubringen. Das älteste und bekannteste Thermit ist eine Mischung von Eisenoxydul von der Zusammensetzung Fe2O3und metallischem Aluminium Al. Das Eisenoxydul ist jene schwärzlich aussehende Eisensauerstoffverbindung, die sich beim Glühen metallischen Eisens an der Luft bildet und in Schmieden und Schlossereien als sogenannter Hammerschlag auftritt. Dies feinkörnige Eisenoxydul und ebenso fein gekörntes Aluminiummetall bilden im Verhältnis von etwa drei zu eins gemischt das Aluminiumthermit.
Für einen Versuch füllen wir einen feuerfesten Tiegel mit etwa 1 bis 2 Kilogramm dieses unscheinbaren Pulvers und bringen ein Sturmstreichholz, das eine besonders heiße Flamme gibt, an das Gemenge. Im Augenblick beginnt die chemische Reaktion. Das Thermit glüht an der entzündeten Stelle hellweiß auf, und die Glut schreitet unter heftigem Funkensprühen schnell durch das ganze Gemenge fort. Die Feuererscheinungen werden so lebhaft, daß man gut daran tut, eine Schutzhaube aus Eisenblech über den Schmelztiegel zu setzen. In etwa 10 Sekunden ist die chemische Reaktion vollendet, und es steht nun eine feurigflüssige Masse mit einer Temperatur von annähernd 3000 Grad Celsius im Schmelztiegel.
Was ist hier geschehen? Die Untersuchung des Schmelzgutes gibt uns die Antwort auf diese Frage. Wir finden im unteren Teile des Tiegels ein außergewöhnlich reines Eisen und darüber geschmolzene Tonerde, d. h. Aluminiumoxydul. Es hat sich also eine chemische Reaktion nach der folgenden Formel abgespielt:
Al2 + Fe2O3 = Fe2 + Al2O3.
Der Sauerstoff hat sich vom Eisen getrennt, so daß dies rein metallisch zurückblieb, und hat sich dafür mit dein Aluminium verbunden. Nun sind sowohl das Eisenoxydul als auch die Tonerde endotherme Verbindungen, d. h. man braucht einen gewissen Energieaufwand, um den Sauerstoff sowohl vom Eisen als auch vom Aluminium zu trennen. Aber die Tonerde ist sehr viel endothermer als das Eisenoxydul. Man kann diese Verhältnisse vielleicht noch bildhafter erklären, wenn man die chemischen Verwandtschaften mit den Goetheschen »Wahlverwandtschaften« vergleicht. Dann läßt sich wohl sagen, daß die Ehe, die der Sauerstoff im Eisenoxydul mit dem Eisen eingegangen ist, nur eine verhältnismäßig lockere Verbindung ist, daß es den Sauerstoff dagegen mit unendlich viel größerer Neigung zum Aluminium hinzieht. Unter diesen Verhältnissen bedarf es dann nur eines verhältnismäßig geringen Anstoßes, den eben das Sturmstreichholz gibt, um die erste Verbindung aufzuheben und den leichtfertigen Partner Sauerstoff in die Arme des geliebten Aluminiums zu treiben. Und so stark ist dabei der Überschwang der Neigung, daß alles in heller Glut erstrahlt.
Nüchterner und zahlenmäßig können wir die Dinge aber auch erklären, wenn wir die Bindungswärmen betrachten. Hier steht das Aluminium an dritter Stelle unter allen uns bekannten Körpern. Die erste und bei weitem höchste Stelle nimmt der Wasserstoff ein. 1 Kilogramm Wasserstoff, welches mit Sauerstoff zu Wasser nach der Formel H2O verbrennt, entwickelt dabei 34 553 Kalorien oder Wärmeeinheiten. An zweiter Stelle steht unser meist benutzter Brennstoff, der Kohlenstoff. 1 Kilogramm Kohlenstoff, welches zu Kohlensäure nach der Formel CO2 verbrennt, entwickele 7859 Kalorien. Dann aber folgt an dritter Stelle das Aluminium. Es entwickelt bei der Verbrennung zu Tonerde nach der Formel Al2O3 7140 Kalorien. Erst in weitem Abstande hinter Mangan, Phosphor, Natrium, Kalzium, Schwefel und Arsen folgt dann das Eisen. Es liefert bei der Verbrennung zu Eisenoxydul von der Formel Fe2O3 1768 Kalorien. Den gleichen Betrag braucht man folgerichtig auch, um das Eisenoxydul wieder in Eisen und Sauerstoff zu zerlegen. Die Differenz dieser beiden Verbrennungswärmen von 7140 Kalorien für Aluminium und 1768 Kalorien für Eisen bildet daher den Wärmegewinn, der frei werden muß, wenn 1 Kilogramm Aluminium verbrennt und 1 Kilogramm Eisen aus seiner Sauerstoffverbindung reduziert wird.
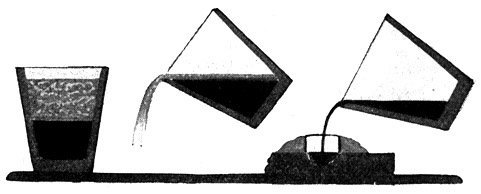
Fig. 81.
Thermit im Tiegel.
Die Thermitreaktion hat sich vollzogen. Im Tiegel (links) steht unten schweres Therrmiteisen, darüber leichte Korundschlacke. Beim Kippen des Tiegels (Mitte) fließt erst die Schlacke ab, danach (rechts) das Thermiteisen, das zum Ausgießen von Defekten an Eisenteilen benutzt wird.
In Wirklichkeit gestalten sich die Verhältnisse noch ein wenig anders, da Aluminium und Eisenoxydul im Thermit im Verhältnis ihrer Molekulargewichte zu mischen sind.
Das Atomgewicht des Eisens beträgt 55,84, das Atomgewicht des Sauerstoffes 16. Ein Eisenoxydulmolekül von der Form Fe2O3 wird daher ein Molekulargewicht von 2×55,84+3×16 = 159,68 haben. Das Aluminium hat das Atomgewicht 27, das Aluminiummolekül daher das Molekulargewicht 2×27 = 54. Nach diesen Zahlen hat man daher im Thermit 160 Teile Eisenoxydul mit 54 Teilen Aluminium zu mischen, und bei der Reaktion sind 111 Gewichtsteile Eisen zu reduzieren und 54 Teile Aluminium zu oxydieren. Aber auch dann noch bleibt ein Kalorienüberschuß verfügbar, der die bereits genannte gewaltige Temperaturerhöhung des Schmelzgutes verursacht.
Der berühmte Physiker Ostwald bezeichnete das aluminothermische Verfahren einmal äußerst treffend als »einen Hochofen und ein Schmiedefeuer in der Westentasche« und kennzeichnete damit ganz besonders die gewaltige Energiedichte, die hier in einfacher Weise erreicht wird. Wie sehr diese Bemerkung zutrifft, zeigen auch die folgenden Zahlen, die Dr. Goldschmidt selbst über das Thermit gibt. Er ging dabei von der Annahme aus, daß beim Abbrennen von 10 Kilogramm Thermit in jeder Sekunde 300 Kalorien entwickelt werden. Nach dem mechanischen Wärmeäquivalent ist 1 Kalorie gleich 425 Meterkilogramm, so daß das Thermit im angenommenen Falle sekündlich 127 500 Meterkilogramm leistet, also mit 1700 Pferdestärken oder mit 1149 Kilowatt in einem mäßig großen Tiegel arbeitet. Um eine ähnlich große Energieentwicklung und Energiedichte zu erzielen, müßte man schon eine elektrische Bogenlampe bei einer Lichtbogenspannung von 40 Volt mit einer Stromstärke von etwa 30 000 Ampere brennen lassen, eine Sache, die technisch kaum durchführbar wäre. Selbst im elektrischen Öfen kann man dem Schmelzgut auf einem gleich kleinen Raum eine solche Energiemenge kaum zuführen.
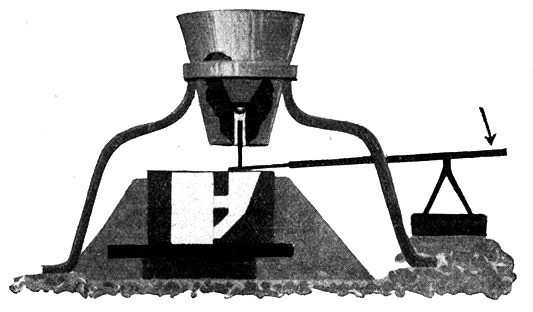
Fig. 82.
Kippt man den Tiegel nicht, sondern schlägt einen Spund im Tiegelboden heraus, so fließt zuerst das reine 3000° heiße Thermiteisen heraus und dann erst die Schlacke.
Über die Energiedichte selbst gibt Goldschmidt noch die folgende Aufstellung. 10 Kilogramm Thermit nehmen nach beendigter Reaktion einen Raum von 3500 Kubikzentimeter ein. Diese 10 Kilogramm entwickeln während des Abbrennens eine solche Energiemenge, daß nach vollendeter Reaktion in jedem Kubikzentimeter 364,2 Meterkilogramm in Form von Wärmeenergie vorhanden sind. Das ist in der Tat eine Energiedichte, die in ähnlicher Höhe in keiner anderen technischen oder chemischen Kombination erreicht wird.
Der Leser könnte vielleicht einwenden, daß Wasserstoff ja eine mehr als viermal so große Verbrennungswärme besitzt als das Aluminium, und daß daher mit der Wasserstoff-Sauerstoffflamme, dem Knallgasgebläse, größere Leistungen erzielt werden müßten. Aber man darf nicht vergessen, daß der Wasserstoff ein Gas ist, und daß 1 Kilogramm davon unter Atmosphärendruck einen Raum von rund 4 Kubikmeter beansprucht, und daß das Ergebnis der Verbrennung, der Wasserdampf, infolge der Erhitzung ein noch beträchtlich größeres Volumen einnimmt. Es lassen sich deshalb mit dem Knallgasgebläse auch nicht annähernd so große Energiedichten, d. h. Konzentrationen einer großen Energiemenge auf einen kleinen Raum, erreichen, wie mit dem Thermit, bei dem keinerlei Gase auftreten und alle Bestandteile vor und nach der Reaktion fest bzw. feurigflüssig sind.
Das Thermit ist nun nicht nur in chemischer Beziehung, sondern auch in technischer Hinsicht interessant und wichtig. Man hat hier, wie gesagt, in einem Schmelztiegel glutflüssiges reines Eisen, auf dem geschmolzene Tonerde als feurig-flüssige Schlacke schwimmt. Es gibt nun zwei Möglichkeiten, dies feurige Schmelzgut aus dem Tiegel zu entfernen. Man kann den Tiegel langsam kippen und wird dann zuerst die oben schwimmende Schlacke abgießen. Man kann aber auch ein im Boden des Tiegels vorgesehenes Zapfenloch ausstoßen und bekommt dann zuerst einen Strahl des heißen Thermiteisens. Beide Arten werden in der Technik für das Flicken und das Schweißen eiserner und stählerner Bauteile verwendet (Fig. 81 u. 82).

Fig. 83.
Die Hitze des ausströmenden Thermiteisens wirkt so stark, daß ein in Wasser befindliches starkes Eisenblech von dem glühenden Eisenstrahl durchgeschmolzen wird, wie eine Wachsplatte von einem Strahl kochenden Wassers.
Von der Hitze und Wirkung des Thermiteisens gibt ein einfacher Versuch eine Vorstellung. Legt man ein starkes Eisenblech hohl unter das Zapfenloch des Tiegels und stößt den Zapfen aus, so geht der heiße Eisenstrahl durch das Eisenblech hindurch wie etwa ein Strahl kochenden Wassers durch eine Wachstafel. In der Technik macht man sich diese Zähigkeit des Thermiteisens, festes Eisen bis zum Schmelzpunkt zu erhitzen, für die Ausführung von Schweißungen gebrochener Maschinenteile zunutze. Die Bruchstelle wird dabei durch Ausmeißeln von Eisen so weit vergrößert und erweitert, daß die Bruchstücke nicht mehr scharf aufeinander passen, sondern ein Spalt von etwa einem Zentimeter Breite zwischen ihnen klafft. Danach werden die Stücke genau in die gegenseitige Lage gebracht, die sie nach ihrer Vereinigung haben sollen, und die Bruchstelle wird mit einer Form aus feuerfestem Ton ummantelt. Diese hat nach oben hin eine Eingußstelle, über der ein Schmelztiegel von genügender Größe aufgebaut und mit der benötigten Thermitmenge beschickt wird.
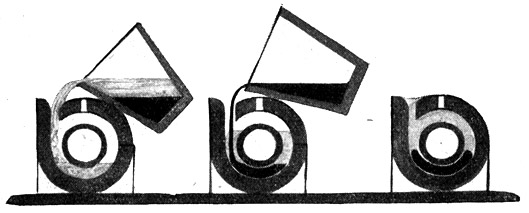
Fig. 84.
Anwendung des Kippverfahrens, um Rohre stumpf zusammenzuschweißen.
Der Tiegel wird in die um den Rohrstoß herumgebaute Form ausgekippt. Unten umhüllt Thermiteisen, oben Korundschlacke den Stoß.
Diese Vorbereitungen nehmen den größten Teil der Zeit in Anspruch. Denn nun folgt das Anzünden des Tiegels, und nach etwa einer Minute kann man das Zapfenloch ausstoßen. Das heiße Thermiteisen läuft in ständigem Strahl in die Form. Es füllt den Spalt zwischen den Bruchstücken, erweicht diese an der Bruchstelle bis zum Schmelzen, vermischt sich mit dem geschmolzenen Eisen und bildet so eine feste, verschmolzene oder verschweißte Verbindung zwischen ihnen, die zum mindesten ebenso fest ist, wie das Material des ganzen Werkstückes. Damit ist die Reparatur vollzogen, und es erübrigt sich nur noch, die Abkühlung abzuwarten und dann die Form abzunehmen.
Bei dem zweiten Verfahren benutzt man nicht das Eisen, sondern die Schlacke. Sind beispielsweise zwei Straßenbahnschienen oder zwei Rohre zu verschweißen, so bringt man diese, mit den stumpfen Stößen aneinandergesetzt, in eine Art Preßvorrichtung, die es gestattet, die Stöße unter sehr starkem Druck aneinanderzupressen. Danach wird eine feuerfeste Form um die Stoßstelle gebaut und nun aus dem Schmelztiegel nach vollzogener Reaktion nur die heiße Schlacke in die Form gegossen. Auch diese erhitzt die Stoßränder bis zur hellsten Weißglut und beginnenden Erweichung. Schon nach wenigen Minuten kann man die beiden Stücke mittels der Presse zusammenziehen, und die Schweißung ist damit vollendet. Nach dem Erkalten und nach Abnahme der Form kann die erstarrte Schlacke mit wenigen Hammerschlägen entfernt werden, da sie sich mit dem Eisen nicht bindet, sondern wie Glas abspringt.
Der Vollständigkeit halber sei auch noch ein besonders für Schienenschweißungen benutztes kombiniertes Verfahren erwähnt, bei dem sowohl das Eisen als auch die Schlacke benutzt werden. Hierbei wird der ganze Inhalt des Schmelztiegels in die Form abgelassen, derart, daß das Thermiteisen den Schienenfuß und den unteren Teil des Schienensteges, die Schlacke den oberen Teil und den Schienenkopf umgibt. Nach dem Zusammenpressen und vollendeter Abkühlung wird der Schienenkopf von der Schlacke befreit, während der Schienenfuß eine dauernde Verstärkung von Thermiteisen erhalten hat. Für die Wichtigkeit und praktische Bedeutung des Verfahrens mag der Umstand sprechen, daß heute bereits mehrere Millionen Schienenstöße nach dem aluminothermischen Verfahren verschweißt sind.
Interesse bietet auch die Schlacke. Sie besteht aus geschmolzener Tonerde, die bei der Abkühlung nicht amorph, d. h. strukturlos, erstarrt, sondern kristallisiert. Kristallisierte Tonerde ist aber nichts anderes als Korund. Korund, der durch ein wenig Chromoxyd rot gefärbt ist, ist nun wiederum nichts anderes als der so hoch geschätzte Edelstein Rubin. Korund, der durch ein wenig Kobaltoxyd blaue Färbung erhielt, bildet einen anderen Edelstein, den Saphir. Chrombeimengungen kommen nun verhältnismäßig leicht vor, sobald das Eisenoxydul aus chromhaltigem Eisen oder Stahl gewonnen wurde. In diesem Falle bilden sich in der erstarrenden Schlacke ganze Nester hübscher roter Kristalle, die sich bei der Untersuchung als reine Rubine erweisen. Bringt man sie beispielsweise in die evakuierte Röhre und setzt sie den Kathodenstrahlen aus, so leuchten sie genau wie die echten Rubine in einem wunderbaren roten Glanze. Im allgemeinen sind es nur kleine Kriställchen, aber gelegentlich bei der Schmelzung großer Thermitmengen und entsprechend langsamer Abkühlung und Erstarrung kommen doch auch recht ansehnliche Kristalle bis zur Bohnengröße vor. Man kann daher mit Fug und Recht behaupten, daß beim aluminothermischen Verfahren Rubine gewissermaßen als Abfallprodukte entstehen. In jedem Falle besteht die gesamte Schlacke aus reinem Korund, der nächst dem Diamanten der härteste Körper ist und daher ein vorzügliches Schleifmittel abgeben muß. Die Thermitschlacke wird daher auch sorgfältig gesammelt, pulverisiert und als ein hochwertiges Schleifmittel verwendet. Sie ist dem Schmirgel, der in der Hauptsache ebenfalls aus Korund besteht, aber stets Verunreinigungen enthält, bedeutend überlegen.
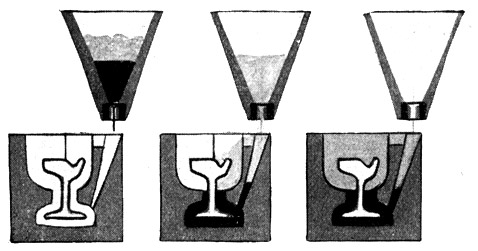
Fig. 85.
Anwendung des Thermites, um Straßenbahnschienen an den Stoßstellen zu verschweißen. Tiegelabstich von unten her.
Eine Eisenlasche bildet sich um den Schienenfuß und die untere Hälfte der Schienen. Die Schlacke, die den Oberteil umhüllt, wird nach dem Erkalten weggeschlagen.
In den bisherigen Betrachtungen haben wir das Aluminiumthermit kennengelernt. Es bestand aus einem gediegenen Metall und einer Metall-Sauerstoffverbindung. Bedingung für eine Thermitreaktion, d. h. für eine chemische Umsetzung unter dem gleichzeitigen Auftreten bedeutender Wärmemengen, war es dabei, daß die dabei entstehende Sauerstoffverbindung des im Thermit vorhandenen gediegenen Metalls wesentlich endothermer war als das Metalloxyd selbst. Nimmt man diese von Goldschmidt für das Thermit gegebene Definition als bindend an, so sind nun sofort eine große Anzahl anderer Thermite denkbar.
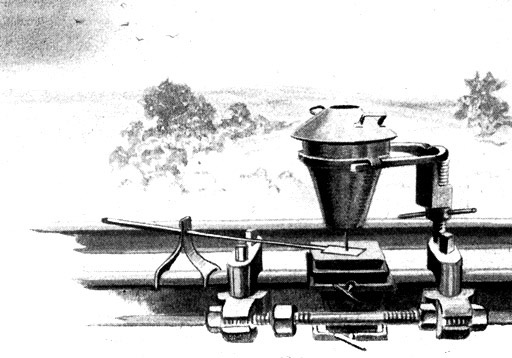
Fig. 86.
Schienenschweißung mittels Thermit.
Die Abbildung zeigt die Preßvorrichtung, mit der die Schienen zusammengepreßt werden, nachdem die Stoßstelle durch das heiße Thermit erweicht ist.
Man kann das Aluminium, dessen hoher Verbrennungswert bereits angegeben wurde, als das gediegene Metall des Thermits beibehalten, aber an Stelle des Eisenoxyduls die Sauerstoffverbindungen anderer Elemente nehmen. Daraus ergibt sich eine Reihe verschiedener Aluminiumthermite, die nun nach vollzogener Reaktion nicht mehr Thermiteisen, sondern das Metall des ihnen jeweilig beigemischten Metalloxyds ergeben. Diese Thermite werden nun in der Praxis besonders zur Darstellung derjenigen Stoffe benutzt, die in der modernen Stahlfabrikation eine Rolle spielen, insbesondere zur Darstellung des Chroms, des Kobalts, des Molybdäns, des Nickels und des Wolframs. Für eine gute und zuverlässige Stahlerzeugung ist es erforderlich, daß diese Stoffe möglichst rein, möglichst frei von fremden und unkontrollierbaren Beimengungen zur Verfügung stehen. Nun ist es ausnahmslos möglich, die Sauerstoffverbindungen der genannten Metalle verhältnismäßig wohlfeil in einer weitgehenden Reinheit darzustellen, während die Reduktion der Metalle selbst aus diesen Sauerstoffverbindungen umständlich und kostspielig wird, wenn man Wert auf ein wirklich reines Erzeugnis legt. Durch das Thermitverfahren ist man dagegen in der Lage, alle diese Metalle in großen Mengen und billig aus ihren Sauerstoffverbindungen zu gewinnen. Als Goldschmidt seine Arbeiten auf dem Gebiete der Thermitchemie begann, war beispielsweise reines Vanadiummetall noch 30mal so teuer als Gold. Man schätzte den Preis eines Kilogramms auf 100 000 Goldmark. Goldschmidt selbst besaß eine Schlipsnadel, die als Schmuckstück ein etwa bohnengroßes Stück gediegenen Vanadiums enthielt. Heute dagegen wird dies Metall nach dem Thermitverfahren tonnenweise in reinem Zustande hergestellt und für die Fabrikation von Vanadiumstahl benutzt.
Eine andere Reihe von Thermiten ergibt sich, wenn man das gediegene Metall verändert, also das Aluminium durch etwas anderes ersetzt. Ohne weiteres können Metalle, die eine ähnlich starke Verwandtschaft zum Sauerstoff besitzen, das Aluminium vertreten.

Fig. 87.
Reparatur des gebrochenen Hinterstevens eines großen Ozeandampfers.
Unten in der Mitte die durch einen Wulst von Thermiteisen kenntliche Reparaturstelle.
Man kann also die Alkalimetalle Kalium, Natrium und weiter auch Kalzium und Magnesium an Stelle des Aluminiums nehmen. Da diese Metalle aber bei der weiteren Thermitreaktion in ihre Sauerstoffverbindungen übergeführt werden, so könnten diese Thermite nur dann praktische Bedeutung gewinnen, wenn die betreffenden Metalle, die bei der Thermitreaktion das Brennmaterial abgeben, erheblich billiger wären als das Aluminium. Da dies jedoch nicht der Fall ist, so haben diese mannigfaltigen Thermite nur wissenschaftliches Interesse. Für die Praxis kommen ausschließlich Aluminiumthermite in Frage. Von ihnen findet das Aluminium-Eisenthermit für die geschilderten Schweißarbeiten weitgehendste Verwendung, während die anderen Aluminiumthermite der Reindarstellung von Metallen für die Zwecke der Hüttentechnik dienen.