
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Aus der großen Zahl der chemischen Elemente fassen wir eine kleinere Gruppe unter der Bezeichnung der Metalle zusammen. Allen Metallen gemeinsam ist der eigenartige metallische Glanz und die Schmelzbarkeit bei höheren oder tieferen Temperaturen. Im allgemeinen sind alle Metalle bei gewöhnlicher Temperatur fest. Die einzige Ausnahme bildet das Quecksilber, welches erst bei 40 Grad unter Null erstarrt. In früheren Jahrzehnten bestand auch eine gewisse Neigung, den gasförmigen Wasserstoff als ein Metall zu betrachten, doch ist man von dieser Anschauung inzwischen wieder abgekommen und stellt ihn heute im natürlichen System der Elemente in die Reihe der salzbildenden Stoffe.
Die Metalle selbst teilt man in edle und unedle Metalle. Unter den ersteren versteht man solche, die sich verhältnismäßig schwer mit dem Sauerstoff zu Oxyden verbinden und deshalb auch in der Natur gediegen gefunden werden. Es sind dies besonders Gold, Silber und die Metalle der Platingruppe. Ein wenig mag aber bei dieser Unterteilung auch die größere oder geringere Seltenheit und die dadurch bedingte Kostbarkeit der Metalle mitgesprochen haben, denn manche unedle Metalle, wie Kupfer, Zinn, Quecksilber und gelegentlich sogar Eisen, werden auch des öfteren gediegen gefunden.
Für die Entwicklung der menschlichen Kultur sind die Metalle von der allergrößten Bedeutung gewesen. Teilen wir doch die Kulturgeschichte geradezu nach den wichtigsten Werkstoffen ein und sprechen vom Steinzeitalter, in dem die Menschheit nur den Feuerstein für ihre Werkzeuge zur Verfügung hatte, vom Bronzezeitalter, in dem sie über eine Legierung von Zinn und Kupfer verfügte, vom Eisenzeitalter, in dem das graue Eisenmetall die goldschimmernde Bronze ersetzte, und schließlich vom Stahlzeitalter, in welchem das Eisen dem mächtigeren Stahl weichen mußte.

Fig. 88.
Die Entdeckung des Metalls.
Aus der Herdmauer der Höhlenmenschen rinnt ein glutflüssiger Strom.
Die Unterscheidung in diese Zeitalter ist übrigens nur bedingt zu verstehen. Auf einzelnen Inseln der Südsee leben wilde Stämme noch heute im Steinzeitalter. Sie kennen keine Metalle und fertigen ihre Waffen aus Stein. Denken wir ferner an die bronzenen Kanonen und an die bronzenen Kirchenglocken, so ragt stellenweise auch in Europa die Bronzezeit noch bis in das letzte Jahrhundert hinein. Gedenken wir andererseits der wundervollen eisernen Schmiedearbeiten indischer und ägyptischer Herkunft, die vermutlich bis in das dritte Jahrtausend vor Christus zurückgehen, so können wir andererseits sagen, daß die Eisenzeit in jenen Ländern schon sehr früh begonnen haben muß.
Wir können es uns wohl denken, wie der Urmensch vergangener Jahrtausende auf die Bronze verfiel. In der Natur findet sich der Zinnstein, ein reines Zinnoxyd von der Form SnO2, ein besonders schweres, dunkles Mineral, welches zweifellos wegen seines hohen spezifischen Gewichtes schon sehr früh als Schleuderstein und Wurfgeschoß in den Kämpfen der Urzeit bevorzugt wurde. In gleicher Weise kommt auch das Kupfer als Rotkupfererz von der Form Cu2O als ein reines Kupferoxyd vor. Will man aus diesen Erzen das gediegene Metall gewinnen, so muß man sie vom Sauerstoff trennen, muß sie also reduzieren.
In der Hüttentechnik ist aber von alters her bis auf unsere Tage die sauerstoffarme reduzierende Flamme das gebräuchliche Mittel für solche Trennungen. Es wird dabei Kohle, d. h. Kohlenstoff unter Sauerstoffmangel, verbrannt, so daß sich nicht Kohlensäure von der Form CO2, sondern nur Kohlenoxydgas von der Form CO bilden kann. Es ist hier das einzige Mal, daß der Kohlenstoff seine sonst ausnahmslos vierwertige Natur verleugnet, zwei seiner Valenzen gewissermaßen in sich selbst bindet und nun mit den beiden anderen nur ein zweiwertiges Sauerstoffatom faßt. Aber diese Verbindung, dies Kohlenoxydgas ist ungesättigt.
Die beiden einstweilen unbeschäftigten, gewissermaßen untereinandergeschlagenen Arme des Kohlenstoffes suchen dringend nach einer Betätigung. Wir merken das sehr zu unserem Leidwesen, wenn wir einmal unglücklicherweise Kohlenstoffoxyd einatmen. Durch Vermittlung der Lunge stürzt es sich sofort auf unsere roten Blutkörperchen und geht mit diesen eine untrennbare Verbindung ein. Auch die Kohlensäure verbindet sich ja im natürlichen Stoffwechselprozeß mit den roten Blutkörperchen. Aber diese Verbindung ist leicht löslich. Sobald das tief blaurot gefärbte Blut unseres Venensystems wieder die Lungen erreicht, trennt sich die Kohlensäure leicht und gern von den roten Blutkörperchen, und mit dem eingeatmeten Luftsauerstoff bilden diese das frische, hellrot gefärbte, arterielle Blut, hat der Mensch dagegen so viel Kohlenoxydgas eingeatmet, daß ein größerer Teil seiner roten Blutkörperchen mit diesem verbunden ist, so ist er verloren. Noch Tage später, nachdem er aus der verderblichen Kohlenoxydatmosphäre gerettet wurde, kann er an innerer Erstickung zugrunde gehen, weil die an das Giftgas gefesselten Blutkörperchen untrennbar damit verbunden bleiben.
Was aber für den menschlichen Organismus so verderblich wirkt, das erweist sich bei der Metallgewinnung als äußerst nützlich. Ein erhitztes Metalloxyd, das von heißen Kohlenoxydgasen umströmt wird, wird stets reduziert werden. Gierig reißt das Kohlenoxyd das Sauerstoffatom an sich, welches es zur Bildung von Kohlensäure benötigt, und gediegenes Metall bleibt an Stelle des Erzes zurück.
Stellen wir uns nun einmal vor, wie die Entdeckung der Bronze in altersgrauer Urzeit wohl vor sich gegangen sein mag. Das Feuer beherrschte der Mensch jener Tage ja schon. In seiner Höhle brannte es Tag und Nacht im sorgsam gemauerten Herd. Aus mancherlei Steinen wurde die Herdmauer gefügt. Der Zufall brachte es mit sich, daß einmal Roterz und Zinnstein zum Bau der Herdmauer benutzt wurden. Des Nachts über sollte das Feuer nur langsam glimmen. Mit Asche und Erde bedeckte man die Herdglut, um ihr den Sauerstoff abzuschneiden, allzu starkes Brennen über Nacht zu vermeiden. Gerade noch zur Bildung von Kohlenoxyd langte die Zufuhr von Luftsauerstoff, und mancher Höhlenbewohner mag zu jenen Zeiten an einer Kohlenoxydvergiftung zugrunde gegangen sein.
Aber in diesem einen Falle fand das Feuer den Sauerstoff ja in der Herdmauer. Kupferoxydul und Zinnoxyd boten ihn dem Kohlenoxydgas der schwelenden Glut willig dar. Als der Morgen kam, da waren die Erze reduziert, nur aus schwammigem Kupfermetall und Zinnmetall setzte sich die Herdmauer zusammen. Und nun sollte die Morgensuppe gekocht werden. Frische Holzscheite wurden in die Glut geworfen, mächtige Flammen loderten aus dem befreiten Herdfeuer. Und dann erlebte jener Höhlenbewohner eine unangenehme Überraschung. Er sah, wie seine scheinbar so fest gefügte Herdmauer plötzlich zusammensackte, wie ein rotglühender Bach aus ihr niederfloß und sich auf dem Höhlenboden ausbreitete (Fig. 88).

Fig. 89.
Die Entdeckung des Metalls.
Die erstarrte Masse, die glutflüssig aus der Herdmauer geflossen war, erweist sich als hämmerbar. Es ist gute Bronze, eine Kupfer-Zinnlegierung.
Einstweilen war nichts dagegen zu tun. Er mußte den Dingen seinen Lauf lassen. Als aber das Feuer niedergebrannt und die Schmelze abgekühlt war, da ging er an die Untersuchung. Er fand einen klingenden Stoff, der goldgelben Glanz gab, als er ihn mit dem Feuersteinmesser schabte. Und er fand, daß sein Messer dabei schnell verdorben wurde, daß dieser neue Stoff härter und widerstandsfähiger war als sein Steinmesser, und daß er sich durch schwere Schläge mit einem Stein formen ließ (Fig. 89).
So wurde die Bronze entdeckt. Tausendmal vielleicht, bis ein forschender Geist den Dingen nachging, den neuen Stoff noch einmal ins Feuer warf, sah, wie er wieder floß, und die Gießkunst erfand. So lernte der Urmensch die Bronze aus ihren Erzen erschmelzen und in Formen gießen. Es war doppeltes Glück bei dieser Entdeckung. Erstens einmal ist die Bronze, jene Legierung aus Zinn und Kupfer, außerordentlich viel härter als das weiche Kupfer und das noch viel weichere Zinn. Zweitens aber schmilzt die Bronze bei geringerer Temperatur, als das ziemlich streng flüssige Kupfer. Während man Kupfer im Kohlenfeuer eigentlich nur bei Verwendung eines künstlichen Zuges niederschmelzen kann, schmilzt Bronze bereits über einem mit natürlichem Zuge brennenden Holzfeuer. Mit dem neu entdeckten Werkstoff begann ein neues technisches und kulturelles Zeitalter. Sehr schnell fand man heraus, daß Bronzemesser und Bronzebeile den Steinwaffen unendlich überlegen waren, und daß man sie in Formen viel schneller und leichter gießen konnte, als man Messer und Beile aus Steinen zurechtschlagen und -schleifen konnte.

Fig. 90.
Die Entdeckung des Eisens.
Ein Meteor wird im Sturze beobachtet. Es besteht aus reinem Nickeleisen, das sich, auf Rotglut erhitzt, ebenso wie Bronze hämmern und schmieden läßt.

Fig. 91.
Herstellung von Eisen aus Raseneisenstein (kohlensaurem Eisenoxid) im Rennfeuer (Frischfeuer).
Das Frischen ist die älteste Art der Eisengewinnung.
Jahrtausende hindurch dauerte das Zeitalter der Bronze. Wiederum bedurfte es besonderer Glückszufälle, um zum nächsten Metall, zum Eisen, zu gelangen. Auch das Eisen kommt, und zwar gewöhnlich mit etwas Nickel legiert, gelegentlich gediegen in der Natur vor. Freilich besteht die begründete Vermutung, daß alles derartige Eisen meteoritischen Ursprungs und zu irgendeiner Zeit einmal vom Himmel auf die Erde gefallen ist. Es leuchtet wohl ein, daß etwas Derartiges auf die Menschen der Urzeit einen ganz gewaltigen Eindruck machen mußte, daß Meteoreisenstücke, deren Sturz man beobachtet hatte (Fig. 90), als etwas besonders Heiliges und von den Göttern Gespendetes in Verwahrung genommen wurden. Auf diese Weise mögen die Menschen der Urzeit in den Besitz des ersten gediegenen Eisens gekommen sein. Der metallartige Charakter dieses neuen Stoffes, eine gewisse Ähnlichkeit desselben mit der bereits bekannten Bronze, dürfte ihnen nicht entgangen sein. Neugier und Wissensdrang können sie veranlaßt haben, dies Eisen dem Feuer auszusetzen und die Schmiedbarkeit des rotglühenden Eisens zu entdecken. Der Hammerschlag, das Eisenoxydul Fe2O3 welches sich dabei bildete, mag dann wohl weiter den Weg zu den natürlichen Eisenerzen von der gleichen Zusammensetzung gewiesen haben, und in logischer Weiterentwicklung bildete sich die Kunst der Eisengewinnung und Verarbeitung heraus.
Noch heute finden wir bei einzelnen, recht tief stehenden wilden Völkern, z. B. bei den Kaffern Afrikas und den Malaien Hinterindiens, die Kunst, mit Hilfe eines äußerst primitiven, dudelsackartigen Gebläses und eines einfachen Holzkohlenfeuers aus dem Raseneisenstein, der sich unmittelbar unter der Erdoberfläche unter dem Rasen findet, ein gutes schmiedbares Eisen zu gewinnen (Fig. 91). Die gewonnenen Mengen sind dabei freilich klein. Ihr Gewicht zählt eher nach Pfunden als nach Zentnern, aber für den geringen Bedarf dieser wilden Stämme reicht das Gewonnene vollkommen aus. Unsere Zeit mit ihrem jährlich nach vielen Millionen Tonnen zählenden Eisenbedarf hat freilich ganz andere Wege eingeschlagen, die, chemisch betrachtet, sogar Umwege zu sein scheinen, aber dafür die wohlfeile Herstellung dieser gewaltigen und in der Qualität stets gleichbleibenden Mengen ermöglichen.
Die moderne Hüttentechnik erschmilzt aus den Eisenerzen zunächst im Hochofen das sogenannte Roheisen, welches, abgesehen von anderen Beimengungen, besonders durch einen hohen Kohlenstoffgehalt von rund 5 Prozent gekennzeichnet ist. Die Eisenerze, von denen der Hochofenprozeß ausgeht, sind besonders der Roteisenstein, ein Eisenoxyd von der Zusammensetzung Fe2O3, der Brauneisenstein, ein Eisenhydroxyd von der Zusammensetzung 2Fe2O3·3H2O, und der Spateisenstein, ein Eisenkarbonat von der Zusammensetzung FeCO3. Aber diese Erze sind kaum jemals vollkommen rein, sondern stets mit steinigen Beimengungen, der sogenannten Gangart, verunreinigt. Das letztgenannte Erz, der Spateisenstein, ist eine Verbindung von Kohlensäure und oxydiertem Eisen. Er läßt sich durch Rösten, d. h. durch kräftiges Glühen, von der Kohlensäure befreien und in einfache Eisensauerstoffverbindungen verwandeln. In der Hauptsache sind es also immer Eisensauerstoffverbindungen, welche durch den Hochofenprozeß vom Sauerstoff und ferner von allen verunreinigenden Gangarten getrennt werden sollen, so daß als Endprodukt ein möglichst reines Roheisen gewonnen wird.
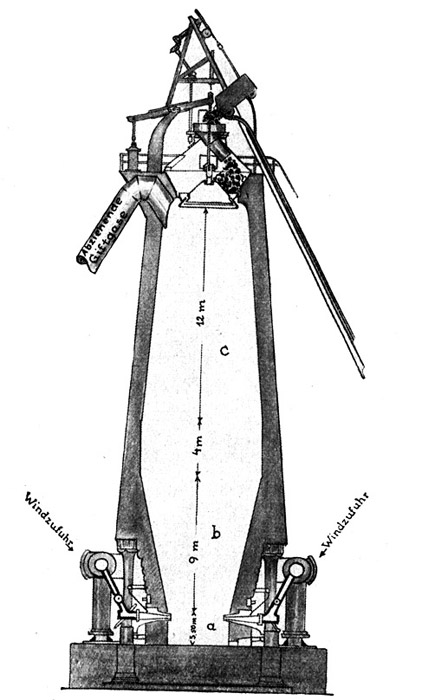
Fig. 92.
Schematische Darstellung der Vorgänge im Hochofen.
Von oben her kommen Eisensauerstoffverbindungen (Eisenerz), Koks (Kohlenstoff) und Oxyde der Alkalimetalle (Zuschläge). Von unten her kommt heißer Sauerstoff (Gebläsewind).
Nach oben entweicht Gichtgas (Kohlenoxyd = CO). Nach unten fließen getrennt ab: Roheisen = Fe + C und Schlacke (geschmolzene Erden).
Der Ort dieses Prozesses ist der Hochofen, den Fig. 92 schematisch veranschaulicht. Aus der Figur geht deutlich hervor, daß der Innenraum dieses Ofens aus zwei abgestumpften Kegeln b und c besteht, die mit den größeren Flächen gegeneinander gerichtet und durch ein zylindrisches Zwischenstück voneinander getrennt sind. An den unteren Kegel schließt sich wiederum ein zylindrischer Teil, das sogenannte Ofengestell a. Verfolgen wir diese Anordnung noch einmal von unten nach oben, um dabei einen Begriff von den Abmessungen eines modernen großen Hochofens zu bekommen. Der Ofenraum beginnt mit dem Gestell a, welches eine Weite von etwa 4 Meter und eine Höhe von 3,5 Meter besitzt. In seinen oberen Teil münden die Windzuführungen e, welche die hocherhitzte Verbrennungsluft, den sogenannten Gebläsewind, unter einem Druck von einer halben bis einer Atmosphäre in den Ofenschacht leiten. Es folgt der kegelförmige Teil b, der sich an seinem oberen Ende bis auf etwa 8 Meter erweitert und etwa 9 Meter hoch ist. An ihn schließt sich der zylindrische Mittelofen von 8 Meter Weite und 4 Meter Höhe, an diesen der zylindrische Teil c, dessen oberes Ende sich bis auf etwa 6 Meter verjüngt. Diese obere Mündung, die Ofengicht, blieb in früheren Jahrzehnten offen, und die hoch aus dem Ofen herauslodernden Flammen boten besonders zur Nachtzeit ein schaurig schönes Bild. Gegenwärtig haben alle Hochöfen verschlossene Gichten. Die Gichtverschlüsse h sind nach dem Prinzip von Schleusen gebaut. Man schleust die für die Beschickung des Ofens erforderlichen Stoffe gewissermaßen in den Ofen hinein, ohne etwas von den wertvollen Gichtgasen zu verlieren.

Fig. 93.
Ansicht eines modernen Hochofens (errichtet von der Deutschen Maschinenfabrik A.-G. Duisburg für die Gute Hoffnungshütte).
Der Hochofen (30 m hoch) verschwindet fast zwischen den zugehörigen Konstruktionen. Im Vordergrund ein Gasreiniger (runder Blechturm), in dem das Gichtgas gereinigt wird. Über dem Hochofen der schräge Gichtaufzug, auf dem Erz, Koks und Zuschläge hinaufbefördert und in die Gicht gekippt werden.
Die Beschickung des Hochofens besteht zu einem Teil natürlich aus dem Eisenerz, welches verhüttet werden soll. Zum anderen Teil ist selbstverständlich Brennstoff notwendig. Dieser kann nach der heutigen Lage nur Koks sein. Der Koks, das feste Endprodukt der trockenen Destillation der Steinkohle, ist ein ziemlich reiner Kohlenstoff, verunreinigt nur durch die Gangart der Kohle, aus der er gewonnen wurde, und leider auch fast immer durch etwas Schwefel, den der Eisenhüttenmann sehr ungern im Hochofen sieht. Den dritten Teil der Beschickung bildet der sogenannte Zuschlag, dessen günstige Zusammenstellung eine Spezialwissenschaft des Hüttenchemikers ist.
Der Zweck des Zuschlags ist der folgende: Beim Verbrennen des Kokses im Hochofen bleiben die erdigen Bestandteile als schwer schmelzbare Koksschlacke zurück und würden nach genügender Zeit den ganzen Ofen erfüllen und verstopfen. Das gleiche gilt von den erdigen Beimischungen der Eisenerze. Der Zuschlag soll nun solche Stoffe enthalten, die mit den Bestandteilen der natürlichen Koks- und Eisenschlacke viel leichter schmelzbare und leichtflüssige Verbindungen eingehen. Der wesentlichste Bestandteil pflegt der Kalkstein zu sein. Er wird insbesondere für solche Erze gewählt, deren Gangart reich an Kieselsäure oder Tonerde ist. Ist im Gegenteil die Gangart selbst reich an Kalk und Magnesia, so wird als Zuschlag Quarz und Tonschiefer gegeben, um die gewünschte Bildung leicht schmelzbarer Silikate (Kieselsäureverbindungen) zu erreichen. Die richtige Zusammensetzung des Zuschlags setzt eine genaue Kenntnis der Gangarten der zu verhüttenden Eisenerze voraus. Durch passende Mischung verschiedener Erzarten sucht man die Mengen der Zuschläge möglichst niedrig zu halten. Aber nur äußerst selten, beispielsweise in dem Hochofenwerk zu Ilsede bei Hannover, gelingt es, ganz ohne Zuschläge auszukommen.
Die Beschickung des Ofens geht nun in der Weise vor sich, daß abwechselnd eine sogenannte Koksgicht, etwa 7 Tonnen Koks, und eine Erzgicht, etwa 15 Tonnen Erz und Zuschläge in den Ofen gegeben werden. Diese beiden Beschickungen wechseln tagein tagaus, jahrein jahraus miteinander ab, solange der Ofen in Betrieb ist, und manche Öfen sind ununterbrochen zwanzig Jahre hindurch in Betrieb geblieben. Es fließt also ein Strom von festen Betriebsstoffen von oben, von der Gicht her, ständig nach unten und muß dort einen Ausweg oder Ablaß finden. Dieser ist auch tatsächlich im untersten Ofenteil, im Gestell, vorhanden, aus welchem abwechselnd das erschmolzene Roheisen und die flüssige Schlacke abgelassen werden.
In umgekehrter Richtung, von unten nach oben, verläuft der Weg des sauerstoffhaltigen heißen Windes, der sowohl die Verbrennung des Kokses als auch die Verhüttung des Erzes zu besorgen hat. Der bis auf 1000 Grad Celsius vorerhitzte Wind tritt mit großer Geschwindigkeit in den Ofen, trifft zunächst auf glühenden Koks und verbindet seinen Sauerstoff mit diesem sofort zu Kohlensäure. Aber dieser Zustand ist nicht von langer Dauer. Weiter strömend trifft der Wind auf immer neue heiße Koksmassen, die ihrerseits auch sauerstoffbegierig sind. Es findet daher wieder eine Aufspaltung der Kohlensäure CO2 und eine Bildung der doppelten Menge von Kohlenoxydgas CO statt. Dieses Kohlenoxydgas ist aber das eigentlich wirksame Mittel des ganzen Prozesses.

Fig.94.
Das Ausgießen des Roheisens aus dem Hochofen in Masseln.
Verfolgen wir nun den Weg der festen Beschickungen von oben nach unten. Sowohl Koks als auch Erz kommen oben kalt in den Ofen hinein, während ihnen von unten her die heißen Ofengase entgegenfließen. Der Prozeß arbeitet hier also wärmetechnisch nach dem oft benutzten Gegenstromprinzip. Während die Ofengase bis auf etwa 200 Grad abgekühlt aus dem Gichtrohr abgeführt werden, wandern die festen Beschickungen nach unten, dabei selbst immer wärmer werdend und in immer heißere Gebiete des Ofens gelangend. Diese sogenannte Vorwärmezone erstreckt sich etwa über das obere Drittel des Ofens. Während die Erze sie passieren, werden sie bis auf etwa 400 Grad Celsius erhitzt. Alles etwa in ihnen vorhandene Wasser wird ausgetrieben und ebenso aus dem Koks und den Zuschlägen.
Es folgt nun der nächste Teil des Ofens bis etwa zum oberen Ende des Kegels b. In diesem Teil steigt die Temperatur bis auf etwa 900 Grad, und die Wirkung des Kohlenoxydes auf die Eisensauerstoffverbindungen beginnt. Innerhalb der Temperaturen bis zu 450 Grad wird das Eisenoxydul Fe2O3 zunächst zu Eisenoxyduloxyd Fe2O3·FeO oxydiert. Bei steigender Temperatur setzt aber die Reduktion ein, so daß schließlich sämtlicher Sauerstoff dem Eisenoxid entrissen und zur Bildung von Kohlensäure Co2 aus dem Kohlenoxid CO verwendet wird, während an Stelle des Eisenerzes jetzt ein metallisches, schwammförmiges, aber noch mit den erdigen Bestandteilen der Erze vermengtes Eisen zurückbleibt.
Während so eine weitgehende Reduktion des Eisenerzes stattfindet, vollzieht sich an der unteren Grenze der Reduktionszone aber noch ein anderer Vorgang. Das Kohlenoxydgas von der Form CO hat in diesen Temperaturen und bei Gegenwart von Eisenoxid eine gewisse Neigung zur Umsetzung. Zwei Kohlenoxydmoleküle von der Form CO bilden ein Kohlensäuremolekül von der Form CO2, während sich der überschüssige Kohlenstoff C in festem Zustande und äußerst fein verteilt auf dem schwammigen, weißwarmen Eisen ausscheidet. Hier aber geht eine weitere Wechselwirkung zwischen dem Eisen und dem Kohlenstoff vor sich. Die Kohle wandert in das Eisen ein. Teils bildet sie mit ihm Eisenkohlenstoffverbindungen, teils wird sie vom Eisen aufgelöst. Die dabei entstehende Eisenkohlenstofflegierung besitzt nun aber einen verhältnismäßig niedrigen Schmelzpunkt, und so schließt sich an die Reduktionszone des Hochofens unmittelbar die Schmelzzone. In einzelnen Tröpfchen rinnt das schmelzende Eisen aus den reduzierten Erzbrocken und fällt weiter nach unten. Von Wert ist dabei eine leichtflüssige Schlacke, welche die einzelnen Tröpfchen mit einer feinen Haut umhüllt und vor weiteren Einwirkungen und Wandlungen schützt.
In der Schmelzzone beginnt nun auch das Zusammenschmelzen der Gangarten von Erz und Koks sowie der Zuschläge zur Schlacke. Aber diese Schlacke enthält vorerst nicht nur diese erdartigen Bestandteile, sondern auch noch einen beträchtlichen Teil von Eisensauerstoffverbindungen der Eisenerze, die der Reduktion widerstanden haben und darüber in die Schmelzzone geraten sind. Die Hochofenschlacke ist also in diesem Teile des Ofens noch stark eisenhaltig, und es wäre ein wenig wirtschaftlicher Betrieb, wenn man sie in diesem Zustande aus dem Hochofen gehen lassen wollte. Aber das Kohlenoxydgas ist nun nicht mehr das geeignete Mittel, um dieses in der Schlacke gebundene Eisen zu reduzieren. Das vermag nur noch der Kohlenstoff selbst bei erheblich höherer Temperatur.
Diese Art der Reduktion bezeichnet man als direkte Reduktion im Gegensatz zu der indirekten durch das Kohlenoxydgas. Die direkte Reduktion geht nun im untersten Teile des Ofens, dem Gestell, vor sich, in welchem der hellweiß glühende Koks mit der flüssigen Schlacke in innigste Berührung und Vermischung gerät, hier wird der Schlacke nicht nur der Eisengehalt bis auf geringe Reste reduziert und entzogen. Es werden auch andere Oxyde, wie Manganoxyd und Siliziumoxyd, von ihrem Sauerstoffgehalt befreit, und die betreffenden Stoffe Mangan und Silizium wandern in das flüssige Roheisen ein und bilden mit ihm Legierungen. Zum Ende des Prozesses steht über dem Bodenstein des Ofengestelles ein Bad von flüssigem Roheisen, über welchem die dreimal leichtere Schlacke schwimmt.
Die Vorgänge im Gestell können durch Beobachtungsluken von außen her verfolgt werden, hat das Eisen- und Schlackenbad eine Höhe bis dicht unter die Windzuführungen erreicht, so wird das Roheisenbad durch die Abflußöffnung abgelassen und danach die Schlacke durch eine etwas höher liegende, auf der anderen Ofenseite befindliche Öffnung abgeblasen. Ein moderner großer Ofen liefert in 24 Stunden bis zu 500 Tonnen Roheisen, und man kann sich danach wohl vorstellen, welche Mengen hier abzulassen sind.
Bevor wir nun dem Roheisen auf seinem weiteren Wege folgen, noch ein Wort über den Ofen. Den Lauf der Beschickung von oben nach unten und das Gegenstromprinzip lernten wir bereits kennen. Von unten wird fortwährend stark komprimierte, sehr heiße Luft durch die Windzuführungen eingeblasen. Man rechnet für die Tonne Roheisen etwa 3200 Kubikmeter Luft. Ein Ofen mit der hier angegebenen Leistung von 500 Tonnen braucht also in 24 Stunden 1,6 Millionen Kubikmeter Luft, braucht in jeder Stunde 66 000 Kubikmeter. Der Stickstoff dieser Luft passiert den Ofen praktisch unverändert. Der Sauerstoff ist zu einem kleineren Teil mit Kohlenstoff zu Kohlensäure verbunden, zum größeren Teil nur zu Kohlenoxydgas. Dies letztere ist aber noch einer weiteren Oxydation oder Verbrennung fähig, wobei es erhebliche Wärmemengen entwickelt. Im Durchschnitt enthält das Gichtgas pro Kubikmeter eine nutzbare Wärmemenge von 800 Kalorien. Für eine Pferdekraftstunde in modernen Großgasmaschinen werden ungefähr 3,5 Kubikmeter Gichtgas benötigt. Ein Hochofen von der hier geschilderten Größe liefert also in seinen täglichen 1,6 Millionen Kubikmeter Gichtgas die Arbeitsmöglichkeit von 450 000 Pferdekraftstunden.
Der moderne Hochofen (Fig. 93) ist demnach nicht nur eine metallurgische Anlage, sondern gleichzeitig ein Kraftgasgenerator größten Stils. Auch wenn man den Energiebedarf abrechnet, der für das Vorwärmen der Gebläseluft, für den Betrieb der Gebläsepumpen und der Kühlwasserpumpen sowie schließlich für den Betrieb der Gichtaufzüge nötig ist, welch letztere die Beschickungen zur Gicht befördern, so bleibt doch immer noch ein gewaltiger Energieüberschuß, welcher den übrigen Anlagen und der weiteren Umgebung des Hüttenwerks zugute kommt. So erklären sich jene gewaltigen Elektrizitätswerke im rheinisch-westfälischen Hüttengebiet, welche elektrische Energie zum Preise von 5 Pfennig für die Kilowattstunde bis weithin nach Hannover und ins Rheinland hinein abgeben. Die Kraftquellen dieser Werke sind die Koksöfen der Kohlenzechen und die Hochöfen der Eisenhütten.

Fig. 95.
Schematische Ansicht eines Roheisenmischers.
In die Eingußtülle (rechts oben) werden mittels Kranpfanne die Abstiche verschiedener Hochöfen eingegossen und gemischt. Durch Kippen der ganzen Apparatur wird flüssiges gemischtes Roheisen wieder nach Bedarf in Kranpfannen ausgegossen. Der Roheisenmischer ist ein aus Kesselblechen zusammengenieteter und mit einer starken feuerfesten Schamottekleidung ausgefütterter Hohlkörper.
Das Ergebnis des Hochofens ist das Roheisen. Jedes Roheisen enthält in erster Linie Kohlenstoff bis zu 5 Prozent des Gesamtgewichts. Je nach der Art, in welcher der Kohlenstoff im Roheisen vorhanden ist, unterscheidet man weißes oder graues Roheisen. Das weiße Roheisen enthält den gesamten Kohlenstoff legiert. Es hat also der Kohlenstoff hier mit dem Eisen wirklich eine chemische Verbindung gebildet, die vielleicht ein Eisenkarbid von der Form CFe2 oder C2Fe ist, deren Molekül aber wahrscheinlich mehrere Kohlenstoff- und Eisenatome enthält. Diese Eisenkohlenstoffverbindung ist dann ihrerseits mit dem Eisen legiert, d. h. sie hat sich in dem flüssigen Eisen ebenso gelöst, wie sich etwa Zucker in Wasser löst, und befindet sich nun nach dem Erstarren des Ganzen in molekularer Verteilung im Eisen. Dieses selbst zeigt einen silberweißen Bruch. Anders liegen die Dinge beim grauen Roheisen, hier ist die Eisenkohlenstofflegierung noch vor dem Erstarren des Eisens wieder zerlegt worden. Der Kohlenstoff befindet sich als blätterförmiger Graphit in feinst verteiltem Zustande im Eisen und verleiht ihm die graue Farbe. Diese Ausscheidung des Kohlenstoffs wird besonders durch einen gewissen Gehalt an Silizium begünstigt. Es tritt dabei das ebenfalls vierwertige Silizium an Stelle des Kohlenstoffes in die Verbindung ein und bildet Siliziumeisen, während der Kohlenstoff frei wird.
Außer dem Kohlenstoff enthält jedes Roheisen etwas Silizium und Mangan. Diese beiden Stoffe stammen teils aus den Gangarten der verhütteten Eisenerze, teils aus den während des Prozesses gegebenen Zuschlägen. Silizium und Mangan sind bis zu einem gewissen Grade nützliche und erwünschte Beimengungen des Roheisens. Dagegen sind die beiden nächsten Stoffe, Phosphor und Schwefel, als unerwünschte Verunreinigungen anzusehen, und ihr Betrag ist möglichst klein zu halten. Nur wenn das Roheisen etwa für eine spätere Verarbeitung nach dem Thomasprozeß bestimmt ist, darf Phosphor in größerer Menge vorhanden sein. Der Phosphor macht das Eisen zwar einerseits besonders dünnflüssig, so daß man mit solchem Eisen sehr feine und detailreiche Formen gut ausgießen kann. Aber andererseits macht er es auch kaltbrüchig. Derartige Gußstücke zerspringen in kaltem Zustande oft schon bei einem leichten Fall wie Glas. Der Schwefel dagegen macht das Eisen rotbrüchig. Schon bei Rotglut wird es bröckelig, und schwefelhaltiges Schmiedeeisen ist vollkommen unschmiedbar, da es unter dem Hammer zerkrümelt.
In unserer Gegenwart ist ein wirtschaftlicher Eisenhüttenbetrieb ohne eine fortlaufende chemische Überwachung und eine dauernde Analyse sowohl der Erze wie des erschmolzenen Roheisens überhaupt nicht mehr denkbar. Die Zeiten, in denen man sich hier auf das Experimentieren und Probieren verlassen konnte, sind längst vorbei. Als Beispiel dafür mag die nachfolgende Stelle aus den Lebenserinnerungen Andrew Carnegies, des amerikanischen Stahlkönigs, zitiert werden:
»Der nächste wichtige Schritt war, einen Chemiker als Mr. Currys Berater und Helfer ausfindig zu machen. Wir fanden ihn in der Person des Dr. Fricke, eines gründlich vorgebildeten Deutschen, der uns unerhörte Geheimnisse entschleierte. Wir erfuhren zum Beispiel, daß Eisenerz aus bestrenommierten Bergwerken 10, 15, ja sogar 20 Prozent weniger Eisen enthielt, als wir angenommen hatten. Man stellte auf einmal fest, daß Minen, die bisher nur einen mäßigen Ruf besaßen, hervorragend gutes Erz lieferten. Das Gute war jetzt schlecht, das Schlechte war gut, es erschien überhaupt alles auf den Kopf gestellt. Neun Zehntel aller Unsicherheit bei der Roheisengewinnung schmolzen wie Wachs unter der warmen Sonne chemischer Kenntnisse.«
Aus der Fülle der in der Hüttenliteratur vorhandenen Roheisenanalysen mögen hier nur einige wenige herausgegriffen werden. Das Roheisen-Syndikat in Düsseldorf schreibt beispielsweise vor, daß Gießereiroheisen Nr. 1 enthalten soll nicht unter 2,5 Prozent Silizium und nicht über 1 Prozent Mangan, 0,6 Prozent Phosphor und 0,04 Prozent Schwefel. Die Analyse für ein gutes graues Siegerländer Roheisen ergab 3-4 Prozent Kohlenstoff, 1-3 Prozent Silizium, 0,3 bis 0,5 Prozent Mangan, 0,2 Prozent Phosphor und Spuren von Schwefel.
Das Roheisen entströmt dem Zapfenloch des Hochofens in dünnflüssigem hellweißglühenden Zustande. Es enthält also eine sehr beträchtliche Wärmemenge. Sofern es nun für Gießereibetriebe bestimmt ist, irgendwo anders in einem Kupolofen als einfaches Gußeisen geschmolzen und dann vergossen werden soll, muß man diese Wärmemenge verlorengeben. Man läßt das flüssige Roheisen einfach in passende Sandformen strömen (Fig. 94) und erhält nach dem Erstarren die sogenannten Roheisenmasseln, welche nun für den Bahnversand fertig sind. Soll aber das Roheisen in der Hütte gleich auf bessere Qualitäten weiter verarbeitet werden, so läßt man sich die im flüssigen Roheisen enthaltene Schmelzwärme nicht entgehen, vielmehr setzt sofort eine sorgfältige und bis in alle Einzelheiten durchdachte Wärmewirtschaft ein, die so weit geht, daß schließlich in der ausgewalzten Stahlschiene noch ein Stück Hochofenwärme steckt.
In diesem Falle läßt man den Abstich des Hochofens in mächtige eiserne, mit feuerfester Schamotte ausgefütterte Kranpfannen laufen, von denen die einzelne an die zwanzig Tonnen flüssigen Eisens faßt. Diese Pfannen werden ihrerseits wieder in die sogenannten Mischer (Fig. 93) ausgekippt. Die Mischer sind sehr große, tankartige Behälter aus festem Stahl mit einer sehr starken Schamotteauskleidung. Nach den Anweisungen des Hüttenchemikers werden die Abstiche verschiedener Hochöfen in einen Mischer gegossen, um so durch die Zusammenmischung verschiedener Roheisensorten ein Gemisch zu erzielen, welches für die weiteren Prozesse besonders geeignet ist. Dabei ist der Wärmeverlust in diesen großen Mischern mit mehreren hundert Tonnen Inhalt so gering, daß man das Eisen stundenlang darin stehenlassen kann, ohne daß es seine Hitze und Flüssigkeit verliert (Fig. 96).
Die weitere Behandlung des Roheisens wird sich nun in erster Linie darauf erstrecken, ihm den allzu hohen Kohlenstoffgehalt abzunehmen. Erst bei einem Kohlenstoffgehalt von 1,6 Prozent an abwärts wird das Eisen schmiedbar und führt den Namen Stahl. Sinkt der Kohlenstoffgehalt bis auf 0,5 Prozent, so verliert der Stahl seine Härtbarkeit und wird einfaches Schmiedeeisen. Wenn man die erste Hälfte des 19. Jahrhunderts noch das Zeitalter des Eisens nennen darf, so hat seitdem ganz entschieden das Zeitalter des Stahls eingesetzt. Unsere Eisenbahnen sind in Wahrheit Stahlbahnen, unsere eisernen Brücken und Träger sind von Stahl. Nur für ganz wenige Zwecke und außerdem als Zwischenprodukt wird noch Schmiedeeisen hergestellt, praktisch kommen für diese Entkohlung des Eisens heute nur zwei Methoden zur Verwendung. Man versteht unter der Bezeichnung Frischen in der Eisenhüttentechnik die Verbrennung oder Oxydation des im Roheisen vorhandenen Kohlenstoffs. Eine besondere Art des Frischens ist das Windfrischen. Dabei wird heißer Wind, d. h. heiße sauerstoffhaltige Luft, unter genügend starkem Druck durch ein weißglühendes Roheisenbad geblasen. Der heiße Wind oxydiert sowohl den Kohlenstoff des Eisens, als auch die anderen Beimengungen, wie Mangan, Silizium, Schwefel und Phosphor.
Die technische Durchbildung des Windfrischens ist eng mit den beiden Namen Bessemer und Thomas verbunden. Henry Bessemer begann seine Versuche in den fünfziger Jahren des vorigen Jahrhunderts. Der Erfolg war verblüffend. Er vermochte eine Roheisenmenge von 3 Tonnen, zu deren Verarbeitung im Puddelofen man bisher 24 Stunden benötigte, in 20 Minuten zu verfrischen. Die ganze Eisenhüttentechnik schien über den Haufen geworfen zu sein. Aber nur allzu bald zeigte es sich, daß die Bäume nicht in den Himmel wachsen. Insbesondere der Phosphorgehalt widerstand der Verbrennung besonders hartnäckig, und man war daher genötigt, für den Bessemer-Prozeß möglichst phosphorfreies Roheisen und das heißt auch phosphorfreie Erze zu verarbeiten. Diese Beschränkung überwand Thomas, indem er die kieselsaure Ausfütterung der Bessemer-Birne durch eine basische Ausfütterung von Dolomitgestein, einem Gemenge von Kalzium- und Magnesiumkarbonat, ersetzte und dem in die Birne gefüllten Roheisen einen Zuschlag von Kalk gab. Nun konnte der Phosphor ebenfalls wegbrennen und als phosphorsaurer Kalk in die Schlacke gehen.

Fig. 96.
Ansicht eines großen kippbaren Roheisenmischers der Gute Hoffnungshütte (Ausführung Demag, Duisburg).
Aus einer Kranpfanne wird Roheisen in die Tülle des Mischers gegossen.
Der Stahl oder das Schmiedeeisen, welche die Enderzeugnisse der Bessemer- oder Thomas-Birne bilden, besitzen einen um rund 400 Grad höheren Schmelzpunkt als das Roheisen. Es wäre daher kaum denkbar, daß das in der Birne erblasene Produkt flüssig bleibt, wenn nicht durch die Verbrennung der genannten Beimengungen des Roheisens selbst gewaltige Wärmemengen frei würden. In der Bessemer-Birne verbrennt zuerst das Silizium. Das Ergebnis dieser Verbrennung ist die Kieselsäure, ein festes, bzw. bei dieser Hitze flüssiges Produkt, welches als Schlacke über dem Eisen schwimmt. Ist der Luftstrom angestellt und die Birne aufgekippt, so vernimmt man zunächst nur ein gurgelndes Rauschen. Es tritt fast nur reiner Stickstoff aus dem Eisenbad heraus, während aller Sauerstoff in der Kieselsäure gebunden wird. Aber nach etwa zwei Minuten ist alles Silizium verbrannt. Es beginnt die Oxydation des Kohlenstoffs zu Kohlenoxyd, das sich in dem verhältnismäßig kleinen Eisenvolumen in gewaltigen Mengen entwickelt, donnernd herausbricht und an der Luft mit hellweißer Flamme zu Kohlensäure verbrennt (Fig. 97). Nach etwa zehn Minuten ist auch der Kohlenstoff ausgeschieden. Die Flamme über dem Birnenmund erlischt, und der Prozeß ist beendigt. In der Birne ist jetzt kohlenfreies Eisen.
Will man unmittelbar Bessemer-Stahl erzeugen, so muß man den Prozeß vor dem vollständigen Verbrennen des Kohlenstoffs abbrechen. Man richtet sich hier einerseits nach dem Aussehen der Flammen auf der Eisenoberfläche. Vielfach wird aber auch das Spektroskop benutzt. Es zeigt unter anderem die Linien der glühenden Mangandämpfe und gibt einen ziemlich genauen Anhalt für das Abbrechen des Prozesses. Während des Blasens ist nun auch eine gewisse Menge Eisen mitoxydiert. Das wäre nicht schlimm, wenn dies Oxyd auch in die Schlacke ginge. Aber es löst sich im Eisen auf und macht dies in hohem Grade rotbrüchig. Deshalb gibt man nun nach der Abstellung des Windes noch eine bestimmte Menge Manganeisens zu. Bei der herrschenden Temperatur ist die chemische Verwandtschaft des Mangans zum Sauerstoff viel größer als die des Eisens. Es reduziert also alles im Bade gelöste Eisenoxydul wieder zu Eisen, und das Manganoxydul geht in die Schlacke. Die Schlacke in der Bessemer-Birne enthält also in der Hauptsache Kieselsäure, Manganoxydul, Eisenoxydul und außerdem von dem feuerfesten Futter herrührend etwas Tonerde, Kalkerde und Magnesia.

Fig. 97.
Bessemer- oder Thomas-Birnen in Betrieb.
Die »Birne« links vorn im zweiten Stadium des Blasens. Der Kohlenstoff des Roheisens verbrennt zu Kohlenoxid, bricht aus dem weißglühenden Eisenbad heraus und verbrennt zu Kohlensäure. Rechts: Eine fertige Birne kippt den Stahl in die Pfanne.
Das Thomas-Verfahren, im Gegensatz zum sauren Bessemer-Verfahren auch als basisches Verfahren bezeichnet, wurde besonders in Deutschland weiter entwickelt und gestattet hier die Verarbeitung phosphorreicher Roheisensorten. Während die Schlacke des Bessemer-Verfahrens fast wertlos ist, nur gelegentlich wegen ihres Mangangehalts den Hochofenzuschlägen zugesetzt wird, ist die Thomasschlacke wegen ihres hohen Gehalts an Phosphorsäure ein äußerst wertvolles Düngemittel. Sie besteht in der Hauptsache aus Kalk und bis zu 23 Prozent aus Phosphorsäure. Die Analyse einer solchen Schlacke ergab 7,07 Prozent Kieselsäure, 22,5 Prozent Phosphorsäure, 0,89 Prozent Tonerde, 5,27 Prozent Eisenoxid, 6,49 Prozent Eisenoxydul, 7,81 Prozent Manganoxydul, 47,36 Prozent Kalk und 1,67 Prozent Magnesia.
Das zweite Verfahren zur Weiterverarbeitung des Roheisens auf Stahl ist als das Siemens-Martin-Verfahren bekannt. Dabei waren die Franzosen Emile und Pierre Martin die Erfinder des chemischen und hüttentechnischen Teils, Friedrich Siemens, der bekannte Heizungstechniker, der Erfinder des wärmetechnischen Teils, der zusammen mit seinem Bruder Wilhelm Siemens das Prinzip der Regenerativfeuerung erfolgreich auf den Martinofen anwandte.
Wir sahen, daß das Roheisen des Hochofens mit rund 5 Prozent Kohlenstoff einen für Stahl zu hohen Kohlenstoffgehalt besitzt, während wir in der Bessemer bzw. Thomas-Birne ohne großen Aufwand ein fast kohlenstofffreies Eisen erblasen können. Gießt man nun Roheisen und Birneneisen in geeigneten Mengen zusammen, so muß man durch diese Mengung Eisen mit jedem gewünschten Kohlenstoffgehalt erzielen können. Das ist der sehr einfache Grundgedanke des Siemens-Martin-Verfahrens. Bei der wirklichen Ausführung darf man sich freilich nicht auf das einfache Zusammengießen beschränken. Wir wissen ja, daß das Roheisen noch mancherlei Beimengungen, wie Phosphor, Silizium und Schwefel, besitzt, die im fertigen Stahl nicht mehr erwünscht sind. Diese Teile müssen durch Oxydation entfernt werden. Man hat es nun im Siemens-Martin-Ofen in der Hand, mit verschiedenen Mitteln und von verschiedenen Seiten her auf das flüssige Eisenbad zu wirken.
Erstens kann man die Flamme, welche das Bad bestreicht, nach Bedarf mit Sauerstoffüberschuß oder -unterschuß brennen lassen, kann sie also nach Bedarf oxydierend oder reduzierend wirken lassen. Zweitens kann man die Ausmauerung des Herdes auch hier »sauer« oder »basisch« herstellen. Gegenwärtig wird fast nur mit basischen Herden gearbeitet, während für die übrige Ofenausmauerung das billigere saure Mauerwerk genommen wird. Drittens endlich kann man durch Einbringen von Eisensauerstofferzen, Kalk und dergleichen unmittelbar auf das Innere das Bades wirken, kann über ihm eine saure oder basische Schlacke erzeugen und dem Bade viel weitergehend alle unerwünschten Beimengungen entziehen, als dies beim Windfrischen üblich ist. So kann man wohl sagen, daß sich im Siemens-Martin-Ofen ein rechter Edelstahl kochen läßt. Ein Blick in einen solchen Ofen gewährt einen wunderbaren Anblick (Fig. 98). Man blickt auf die weite weißglühende Fläche des flüssigen Stahls und sieht, wie die Gase aus ihm herausbrodeln und hier und dort kleine Stahlfontänen emporwerfen. Die Analysen für den Siemens-Martin-Stahl ergeben ähnliche Werte wie für den windgefrischten Stahl. Siemens-Martin-Schienen hatten beispielsweise 0,36 Prozent Kohlenstoff, 0,16 Prozent Silizium, 0,98 Prozent Mangan, 0,04 Prozent Phosphor und 0,05 Prozent Schwefel.
Der Stahl, welcher der Frischbirne oder dem Siemens-Martin-Ofen entnommen wird, ist reif für die weitere Verarbeitung. Er wird in Gießpfannen eingelassen und in hohe Formen mit quadratischem, nach oben verjüngtem Querschnitt eingegossen. Nach einer genau bekannten Zeit zieht ein Zangenkran die Form ab, ein zweiter Kran faßt das noch hellrot glühende Gußstück, die Bramme oder Luppe, und mit Windeseile geht es zum Walzwerk, wo die stählernen Massenprodukte, die Schienen, Träger, Profileisen und Bleche, entstehen.
Es war ein langer und dornenvoller Weg vom Rennfeuer oder vom Frischfeuer der Urmenschen bis zum modernen Eisenhüttenwerk. Heute ist die Stahlerzeugung eine ausgesprochene Massenerzeugung. Auf der Erde werden heute alljährlich etwa 200 Millionen Tonnen Stahl und Eisen gewonnen und restlos verbraucht.
Nächst dem Eisen ist das Kupfer für unser Zeitalter der Elektrotechnik das wichtigste Metall. Während uns das Eisen von der Natur aber in Form ziemlich reiner Sauerstofferze geliefert wird, liegen die Dinge beim Kupfer nicht so einfach. Solche Sauerstoffkupfererze kommen ziemlich selten vor. Dagegen finden sich bemerkenswerterweise ziemlich umfangreiche Gänge und Nester von gediegenem Kupfer in der Natur. So hat man beispielsweise am Oberen See in den Vereinigten Staaten gediegene Kupferblöcke in Einzelgewichten bis zu 3000 Kilogramm gefunden. Auch auf der Insel Zypern, von der das Kupfer (lateinisch cuprum) seinen Namen hat, soll es im Altertum in beträchtlichen Mengen gediegen vorgekommen sein. Es ist auffallend und schwer erklärlich, daß sich in diesem natürlichen kristallinischen Kupfer auch andere Metalle, wie z. B. Silber, gediegen vorfinden, die nicht mit ihm legiert sind, wie es unbedingt der Fall sein müßte, wenn diese Metalle aus einer flüssigen Schmelze erstarrt wären. Sonderbarerweise finden sich nun aber auch antike Kupfergefäße, welche ebenfalls derartig punktförmiges Silber eingesprengt enthalten, und einige Forscher vertreten die Meinung, daß die Alten noch gar nicht imstande waren, Kupfererze zu verhütten. Sie nehmen an, daß diese das natürlich vorkommende gediegene Kupfer höchstens schmolzen und mit Zinn zu Bronze legierten, daß sie aber ihre Kupfergeräte unmittelbar aus dem Naturkupfer schmiedeten und trieben.
Die verbreitetsten Kupfererze sind das Rotkupfererz von der Form Cu2O, die kohlensauren Kupfererze Malachit und Kupferlasur, und ganz besonders der Kupferkies, eine Verbindung von Schwefeleisen und Schwefelkupfer von der Form CuFeS2. Während die Kupfergewinnung aus den erstgenannten Erzen verhältnismäßig einfach ist, bietet die Verhüttung des Kupferkieses beträchtliche Schwierigkeiten.
Der Prozeß beginnt mit einer Trennung des Kupfererzes von seinem Ganggestein nach der sogenannten Flotationsmethode. Die Erze werden fein gemahlen und mit Wasser und ein wenig Holzteeröl angerührt. Es bildet sich auf der Flüssigkeit eine Schaumschicht, welche alles Erz enthält, während die Gangart zu Boden sinkt. Aus dem Schaum gewinnt man durch Abpressen ein konzentriertes Erz, welches nun zunächst geröstet, d. h. bis zur Rotglut erhitzt wird. Durch diesen Prozeß wird ein erheblicher Teil des Schwefels in Form von schwefliger Säure OS als Gas ausgetrieben, während andererseits Luftsauerstoff in das Erz einwandert und Kupferoxyd von der Form CuO bildet. Das durch diese Röstung gewonnene Produkt wird unter Beigabe von kieselsäurehaltigen Zuschlägen und Kohle verschmolzen. Dabei bindet sich das Eisen mit dem Silizium der Kieselsäure zu Eisensilikat und geht in die Schlacke. Die beigegebene Kohle wirkt ihrerseits reduzierend auf das Kupferoxyd, während die Glühhitze weiter Schwefel austreibt. So kommt man durch einen mehrfach wiederholten Prozeß von abwechselndem Rösten und Glühen schließlich zum metallischen Kupfer, dem sogenannten Garkupfer. In neuerer Zeit hat man auch die Bessemer-Birne in etwas gewandelter Gestalt in den Dienst der Kupfergewinnung gestellt und reinigt das flüssige Kupferbad durch einen hindurchgeblasenen Luftstrom.
Wir sahen bei der Eisengewinnung, daß das fertige Erzeugnis auch des Siemens-Martin-Ofens noch keineswegs ein chemisch reines Eisen ist, sondern prozentuale Beimengungen anderer Stoffe enthält. Freilich sind diese Beimengungen für den Stahl zum Teil unbedingt notwendig und unentbehrlich. Anders liegen die Dinge beim Kupfer. Es wird ja zum größten Teil in der Elektrotechnik verwandt, wo es in erster Linie auf die hohe Leitfähigkeit für elektrische Ströme ankommt. Die Leitfähigkeit des Kupfers wird aber durch geringfügige Beimengungen von Bruchteilen eines Prozents schon sehr bedeutend verschlechtert. Man braucht in der Elektrotechnik ein Kupfer von einer Reinheit, wie man es nach irgendeinem Hüttenverfahren niemals herstellen kann. Bringen doch die Flamme und das Ofenfutter in jedes noch so reine Metall Zusätze hinein, ganz abgesehen von denjenigen Stoffen, die bei der hier beschriebenen schwierigen Verhüttung ohnehin unentfernbar sind.
In dieser Verlegenheit hat sich die Elektrolyse als Helferin erwiesen. Sobald das Kupfer als Garkupfer vorliegt, verzichtet man auf alle weiteren hüttenmännischen Raffinierungsversuche. Das Garkupfer wird in Form großer, ziemlich starker Bleche oder Platten ausgegossen, und diese kommen in ein Kupfervitriolbad, in dem sie als Anoden dienen, während ihnen feine Reinkupferbleche als Kathoden gegenüberstehen. Unter der Einwirkung eines genügend starken elektrischen Stromes löst sich das Garkupfer der Anoden zu Kupfervitriol, während die entsprechende Kupfermenge an der Kathode als Elektrolytkupfer niedergeschlagen wird. Dabei fallen alle Verunreinigungen des Garkupfers als sogenannter Anodenschlamm zu Boden, und an den Kathoden schlägt sich ein Metall nieder, welches zu wenigstens 99,9 Prozent aus reinem Kupfer besteht, höchstens noch 1 pro Mille Verunreinigungen enthält. Wir werden auf das Verfahren noch in dem Abschnitt von der Elektrochemie zurückkommen.
Bei der Schwierigkeit und Umständlichkeit der Verhüttung des Kupferkieses sind gegenwärtig Bestrebungen im Gange, das elektrolytische Verfahren so früh wie möglich einzusetzen. Stellenweise elektrolysiert man bereits den sogenannten Kupferstein, jenes nach dem ersten Rösten des Kupferkieses gewonnene Gemisch von Schwefelkupfer und Schwefeleisen. Wenn auch die Erfahrungen über diesen Prozeß noch nicht abgeschlossen sind, so bleibt doch das Bestreben bemerkenswert, die chemischen Reaktionen der Flamme und der Zuschläge, welche bisher in allen Hüttenprozessen die Hauptrolle spielen, in weitgehendem Maße durch elektrolytische Vorgänge zu ersetzen. Bestimmend dafür ist die Beobachtung, daß die Elektrolyse bei geeigneten Bädern, Spannungen und Stromdichten auch bei Verwendung sehr stark verunreinigter Anoden ein Produkt von erstaunlicher Reinheit liefert.

Fig. 98.
Einbringen einer Charge (Ladung gepreßter Schmiedeblechabfälle) in den Siemens-Martin-Ofen.
Die Chargiermaschine schiebt einen großen »Löffel« voller Blechabfälle durch die geöffnete Tür in den Ofen.
Während des Weltkrieges stieg die Kupfernot in Deutschland von Monat zu Monat, da für die Granatringe, die sich zäh und weich in die Züge der Geschützrohre einpressen müssen, reines Kupfer das einzige als brauchbar bekannte Material war. In der Not der Zeit wandte man nun auch auf das im hüttenmännischen Verfahren gewonnene Eisen die Elektrolyse an und gewann ein ebenfalls beinahe chemisch reines Eisen mit überraschenden Eigenschaften. Das Siemenssche Elektrolyteisen besaß eine Geschmeidigkeit, Zähigkeit und Weichheit, welche derjenigen des Elektrolytkupfers kaum nachstand und seine Verwendung zu Granatringen, Patronenhülsen und dergleichen ohne weiteres gestattete. Nur mußte die weitere Verarbeitung dieses Eisens frei von jeder Flammenbehandlung erfolgen, da schon die geringsten Verunreinigungen seine wertvollen Eigenschaften wieder vernichteten.
An dritter Stelle mag das Zinn genannt werden. Die Natur bietet es uns vornehmlich als ein Sauerstofferz dar, den Zinnstein von der Form SnO2. Aber leider sind die Erze sehr häufig durch Beimengungen von Schwefel und Arsen verunreinigt. Es gibt auch reine Zinnoxyd-Vorkommen. Dann sitzt der schwere schwarze Zinnstein nesterförmig im Gestein und wird herausgehauen (Fig. 99). Die Erze müssen daher vor der Verhüttung durch scharfes Rösten vom Schwefel und dem größten Teil des Arsens befreit werden. Danach erfolgt die Verhüttung, die nun in der Hauptsache eine Reduktion ist, wobei sich der Sauerstoff des Zinnoxyds mit der als Zuschlag gegebenen Kohle zu Kohlensäure verbindet, während reines Zinn erschmolzen wird.
Im Altertum bildete Zinn in Verbindung mit Kupfer die wertvolle Bronze. In unseren Tagen ist die Bronze als Gebrauchsmetall zum größten Teil durch das Eisen ersetzt worden. Legieren wir heute das Kupfer, so nehmen wir meist Zink hinzu und erhalten so das Messing, welches in der Technik weitgehende Anwendung findet. Das reine Zinn wird, fein ausgewalzt, als Zinnfolie oder Stanniol besonders zum Verpacken von allerlei Waren benutzt, die gegen die Luftfeuchtigkeit geschützt werden müssen. Weiterhin hat die vorzügliche Gießbarkeit des Zinns aber auch das Kunstgewerbe angeregt, und seit dem frühen Mittelalter hat die Zinngießerei wertvolle Stücke in großer Zahl erzeugt. Stücke, die aber alle von einem unheimlichen Feind bedroht zu sein scheinen.
Das Zinn gehört nämlich zu jenen Stoffen, die wie Phosphor, Schwefel und Kohlenstoff in verschiedenen Modifikationen vorkommen. Während das gewöhnliche Zinn ein silberweißes Metall vom spezifischen Gewicht 7,3 ist, gibt es auch eine graue Modifikation, welche pulvrig ist und das spezifische Gewicht 5,8 besitzt. Bei tiefen Temperaturen geht nun das weiße Zinn in die graue Modifikation über. Dieser Übergang erfolgt ganz unkontrollierbar zunächst an wenigen, winzig kleinen Stellen. Es scheint sogar, als ob dazu noch eine chemische Einwirkung gehört, bei der Verbindungen des Zinns mit Chlor und Ammoniumchlorid eine Rolle spielen. Betupft man beispielsweise weißes Zinn bei tiefen Temperaturen mit einer solchen Verbindung, dem sogenannten Pinksalz von der Form SnCl4·2NH4Cl, so verwandelt es sich unmittelbar in graues Zinn. Wenn nun aber auch nur einige wenige Moleküle eines Zinngußstückes in die graue Modifikation verwandelt sind, so geht dieser Prozeß unaufhaltsam weiter, solange die Temperatur weniger als 15 Grad Celsius beträgt. Das Stück wird über immer größere Stellen hin stumpf grau, erinnert an wurmzerfressenes Holz und bröckelt schließlich auseinander.
Das ist die gefürchtete Zinnpest. Sie hat in Sammlungen und Museen an wertvollen alten Stücken böse Verheerungen angerichtet, bevor es gelang, ihr Wesen zu ergründen und Mittel zur Abwehr zu finden. Als sie zuerst so merklich und fühlbar auftrat, schien es, als wäre jene mittelalterliche Alchimistensage vom Eisenwurm, der Eisen zerfrißt wie der Holzwurm das Holz, für das Zinn Wahrheit geworden. Heute weiß man, daß es sich hier um die Umwandlung einer Zinnmodifikation in die andere handelt, wahrscheinlich begünstigt durch unsere im Steinkohlenzeitalter mit allerlei Chlor- und Ammoniakdämpfen verunreinigte Luft. Denn sonst hätte man die Zinnpest schon in früheren Jahrhunderten bemerken müssen. Das Heilmittel gegen diese Krankheit ist Wärme. Bei einer Temperatur von mehr als 15 Grad Celsius tritt die Umwandlung nicht mehr ein, bei einer Temperatur von mehr als 20 Grad geht die bereits eingetretene Umwandlung sogar wieder zurück. Nur leider wird die Schönheit des Kunstwerks dadurch nicht rekonstruiert, denn das sich zurückbildende weiße Zinn hat die aufgeplusterte Struktur des grauen Zinnes, so daß die Form des Gußstückes gestört bleibt.

Fig. 99.
Blick in ein Zinnbergwerk. Untertagebau.
Der nesterförmig vorkommende Zinnstein wird aus dem tauben Gestein herausgehauen.
Das Blei sei als viertes Metall genannt. Es kommt in der Natur vornehmlich als Bleiglanz oder Schwefelblei von der Form PbS vor. Auch hier bildet die Röstung die erste Stufe der Verhüttung. Sie treibt einen Teil des Schwefels als schweflige Säure aus. Dafür wandert Sauerstoff ein und bildet Bleioxyd PbO. Zum anderen Teile wandert Sauerstoff in das Schwefelblei und bildet Bleisulfat von der Form PbSO4. Durch Beigabe von Kieselsäure wird das Bleisulfat in Bleisilikat verwandelt, und danach erfolgt die reduzierende Schmelzung im Schachtofen unter Beigabe von Koks, wobei einerseits Kohlensäure entweicht, andererseits Blei erschmolzen wird.
Als fünftes Metall, welches in unserer gegenwärtigen Kultur eine unentbehrliche Rolle spielt, sei das Zink genannt. Die Natur bietet es uns vornehmlich als kohlensaures Sauerstofferz von der Form ZnCO3. Das ist der Zinkspat oder Edelgalmei. Außerdem wird auch das Schwefelerz ZnS, die Zinkblende, verhüttet. Bei dieser muß der Verhüttung wieder das Rösten vorausgehen, durch welches der Schwefel ausgetrieben und Zinkoxyd gebildet wird. Es folgt das Schmelzen im Ofen, wobei das Zinkoxyd mit Kohle gemischt und niedergeschmolzen wird. Nun liegt aber der Verdampfungspunkt des dabei entstehenden reinmetallischen Zinkes mit 920 Grad so niedrig, daß es ebenfalls als Dampf abgeht. Die Dämpfe des Ofens müssen daher in einer Kühlvorlage aufgefangen werden. Hier scheidet sich das Zink als feiner Staub aus und kann nun in einem anderen Ofen bei geringerer Temperatur zu den handelsüblichen Blöcken verschmolzen werden.
Die fünf Metalle: Eisen, Kupfer, Blei, Zinn und Zink geben unserer heutigen Kultur das Gepräge. Es sind ausgesprochene Schwermetalle im Gegensatz zu den Leichtmetallen, von denen besonders das Aluminium erwähnt sein mag. Fast scheint es aber, als ob wir heute bereits in einer Übergangszeit stehen und ein neues Zeitalter der Leichtmetalle in der Geschichte menschlicher Kultur beginnen will. Schon spielt die Legierung des Aluminiums mit Magnesium, das Duralumin im Luftschiff- und Automobilbau eine bedeutsame Rolle. Vielleicht folgt auf die Eisenzeit die Aluminiumzeit, wie früher einmal das Eisen die Bronze ablöste.