
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Wir lernten in den vorhergehenden Abschnitten einige Tatsachen aus dem weiten Gebiete der theoretischen Chemie kennen und außerdem mehrere industrielle Anwendungen solcher Tatsachen. Aber es wäre verkehrt, nun etwa anzunehmen, daß alle chemische Betätigung sich auf das Laboratorium und die chemische Fabrik beschränkt. Das Gegenteil ist der Fall. Unser ganzes Leben spielt sich zu einem sehr großen Teil auf chemischem Gebiete ab. Unser eigener Körper ist eine chemische Fabrik von solcher Mannigfaltigkeit und Kunstfertigkeit, daß kein anderes chemisches Werk sich damit vergleichen läßt. Aber auch unsere nächste Umgebung, die vielen Gebrauchsgegenstände, die wir täglich benutzen, unterliegen mehr oder weniger chemischen Einwirkungen und Umwandlungen. Eine kurze Betrachtung aller dieser Dinge wird uns vielleicht manches vom Gesichtspunkte des Chemikers aus erklären, was sonst nur schwer erklärlich wäre.
Beginnen wir mit unserer Kleidung. Unsere Leibwäsche, das leinene Hemd, Kragen, Manschetten usw. sind im Laufe der Zeit etwas schadhaft geworden. Man entsinnt sich der alten Regel, daß man kleine Löcher flicken solle, bevor sie größer werden, und handelt danach. Aber diese sonst gut gelungene Flickarbeit bereitet uns in ihren weiteren Folgen doch keine reine Freude mehr. Unmittelbar neben dem neuen Flicken reißt die alte Leinwand wiederum (Fig. 141). Die Hausfrau tröstet sich schließlich mit dem Erfahrungssatz, daß alte Leinwand eben schließlich mürbe wird. Wir aber können uns den Vorgang jetzt genauer erklären.

Fig. 141.
Es lohnt sich nicht mehr zu flicken, wenn die Wäsche mürbe geworden ist. Im Laufe der Zeit hat sich die Zellulose in Hydrozellulose verwandelt und der Stoff reißt neben jedem aufgesetzten Flicken von neuem.
Wir wissen ja, daß der Leinwandfaden aus reiner Zellulose besteht, daß er ein Kohlenhydrat von der Form (C6H10O5)x ist. Wie hat man diesem Zellulosefaden aber während der Jahre, da er uns Dienste tun mußte, zugesetzt. Wie oft kam das Hemd in die Wäsche und wurde dort in scharfer Seifenlauge gekocht! Wie hingen die nassen Wäschestücke dann in der Luft zum Bleichen, dem atmosphärischen Sauerstoff und der chemischen Wirkung der Sonnenstrahlen ausgesetzt! Wie fuhr dann das heiße Bügeleisen über die zarten Leinenfasern!
Ist es ein Wunder, daß diese recht scharfen Reagenzien im Laufe der Zeit auch eine chemische Reaktion hervorriefen? Sie ist in der Tat eingetreten. In das Kohlenhydrat sind im Laufe der Zeit neue Hydrogruppen von der Form H2O eingewandert und haben die molekulare Struktur verändert. Die äußere Form hat dabei gar keine Veränderung erlitten. Die Fäden des Leinengewebes zeigen auch unter dem Mikroskop ihre alte Form. Aber die Festigkeit hat um so mehr Schaden gelitten.
Die reine Hydrozellulose von der Form (C6H12O6)x ist nämlich ein leicht zerreiblicher Stoff. Wollten wir mit der Beschaffung eines neuen Hemdes so lange warten, bis das alte ganz und gar Hydrozellulose geworden ist, so würde uns dies pulverartig in Staub zerfallen. Aber in der Praxis kommt es nicht so weit. In dem Maße, in dem sich Teile der Leinenfäden in Hydrozellulose verwandeln, müssen die übrigbleibenden ja die ganze Sorge für die Festigkeit übernehmen. Das geht aber nur eine Weile, nämlich gerade so lange, bis für die übrigbleibenden Zellulosefasern die Festigkeitsgrenze erreicht ist. Dann beginnt der Stoff dort, wo er gerade ein bißchen unsanft angefaßt wurde, zu zerreißen, und daran kann nun auch kein Flicken mehr etwas bessern. Es bleibt nur übrig, das bis zu diesem Grade »hydrierte« Hemd zu pensionieren und in Putzlappen zu zerlegen.
Noch an einer anderen Stelle unserer Garderobe können wir ein auffallend rasches Mürbewerden von Zellulosefasern beobachten, nämlich an den Schnürsenkeln. Wir haben sie unter allerlei hochtrabenden Bezeichnungen, wie Eisengarn und dergleichen, gekauft. Aber in Wirklichkeit bestehen auch sie aus reiner Zellulose, aus Leinen- oder Baumwollfasern, und ein erschwerender Umstand kommt hinzu. Die Schnürsenkel befinden sich ja von Berufs wegen in nächster Nachbarschaft des Stiefelleders, welches dauernd mit Stiefelwichse behandelt wird. Die Stiefelwichse aber enthält fast stets etwas freie Schwefelsäure. Schwefelsäure und Zellulose reagieren sehr lebhaft aufeinander, wobei die Zellulose eine Umwandlung teils in Hydrozellulose, teils in Dextrose, Dextrin und dergleichen erfährt. Jedenfalls wird der an sich feste Zellstoffaden in Verbindungen von ähnlicher molekularer Zusammensetzung, aber sehr viel geringerer Festigkeit, verwandelt.
Der praktische Erfolg dieses Vorganges dürfte wohl jedermann hinlänglich bekannt sein (Fig. 142). Der Schnürsenkel, der äußerlich noch durchaus einen haltbaren und neuen Eindruck macht, reißt eines schönen Morgens beim Zuschnüren des Stiefels wie Zunder auseinander. Manchmal wird die Schuld daran irrtümlicherweise auf einen scharfkantigen Schnürhaken geschoben, der den Senkel heimtückischerweise zerscheuert haben soll. Aber dieser Fall tritt nur selten ein In Wahrheit ist die Schwefelsäure der Stiefelwichse die Schuldige, und der Fortgang der Ereignisse erbringt den Beweis dafür. Es bleibt nämlich nicht bei dem einen Riß.

Fig. 142.
Die Stiefelwichse ist meistens etwas schwefelsäurehaltig. Dem Leder schadet das nichts, wohl aber den leinenen Schnürsenkeln, die dadurch schnell brüchig werden und trotz allem Zusammenknoten nicht mehr zu brauchen sind.
Natürlich wurde der Senkel geknotet und zunächst ruhig weiter benutzt. Aber schon nach wenigen Tagen reißt er an einer zweiten, dritten und vierten Stelle. Es geht hier mit dem Mürbewerden genau wie beim Hemd, hat es erst einmal merklich damit angefangen, so hilft kein Flicken mehr.
Die Empfindlichkeit der Zellulose gegen Säuren aller Art und namentlich gegen Schwefelsäure macht sich natürlich besonders dort bemerkbar, wo man berufsmäßig mit solchen Säuren zu tun hat. Das gilt besonders für Elektriker, welche große Akkumulatorenbatterien zu überwachen haben. Während sonst der blaue Leinenanzug die Berufstracht dieser Leute zu sein pflegt, tragen Batteriewärter grundsätzlich reine Wollenanzüge, weil die Wollfaser, die ja eine ganz andere chemische Zusammensetzung hat, von der Säure viel weniger angegriffen wird.

Fig. 143.
Die Behandlung der Leinenwäsche mit Säuren, z. B. die Benutzung des Taschentuches seitens junger Radioenthusiasten zum Aufwischen von Schwefelsäure, beschleunigt den Zerfall der Zellulose.
Unser Radiozeitalter hat dem Schwefelsäureakkumulator aber auch weitgehendste Verbreitung in den privaten Haushaltungen gebracht (Fig. 143), und so manches leinene Taschentuch dürfte im letzten Jahre durch diesen Umstand vorzeitig zugrunde gegangen sein. Es ist ja so bequem, ein paar Tropfen der verdünnten Schwefelsäure, die etwa beim Nachfüllen der Batterie übergegossen wurden, mit dem Taschentuch aufzutupfen. Und das Taschentuch reagiert äußerlich auch scheinbar gar nicht darauf. Es schluckt die Säure wie Wasser. Aber während das Wasser bald verdunsten würde, bleibt die Säure im Tuch. Die Säureflecke bleiben feucht, bis nach Tagen oder Wochen das Tuch in die Wäsche kommt. Und dann offenbart sich die Wirkung. Die Stellen der Säureflecken sind vollkommen mürbe geworden.

Fig. 144.
Wird ein sofortiges Auswaschen der Säureflecke unterlassen, kommen derartig mißhandelte Tücher erst nach längerer Zeit in die Wäsche, so findet man Löcher, wo die Säure das Leinen berührte.
Genau so weit, wie die Säure gereicht hat, verkrümelt sich der Stoff bei der mechanischen Prozedur des Waschens, und mit den entsprechenden Löchern verziert kommt das Tuch aus der Wäsche (Fig. 144). Es wäre zu retten gewesen, wenn man es sofort in eine kräftige Sodalösung gebracht hätte. Wenn das unmittelbar nach der beschriebenen Untat geschah, so fand eine Reaktion zwischen der Schwefelsäure H2SO4 und der Soda von der Form Na2CO3 statt, bevor die Säure die Zellulose merklich angreifen konnte. Aus der basischen Soda und der Säure bildete sich ein neutrales Salz, welches überdies durch die Lauge aus dem Gewebe herausgewaschen wurde. Aus diesem Vorgang folgt die allgemeine Regel, daß man Flecken irgendeiner scharfen Säure in einem Gewebe möglichst sofort nach ihrer Entstehung durch Sodalauge neutralisieren und unschädlich machen soll (Fig. 145).

Fig. 145.
Mit scharfen Säuren in Berührung gekommen Wäschestücke müssen sofort kräftig gespült und am besten mit Sodalauge nachgespült werden.
Das Leben bringt es mit sich, daß unsere Kleidung und Wäsche manchen Flecken ausgesetzt sind. Abgesehen von den ebengenannten Säureflecken kommen besonders in Betracht Tintenflecke und Flecke von Obstsäften und Weinen. Bei den heute allgemein gebräuchlichen Eisengallustinten werden Tintenflecke sehr unangenehm, wenn man ihnen nicht sofort nach ihrer Entstehung energisch zu Leibe geht. Diese Tinten schreiben bekanntlich zunächst blau, vermittelst eines in ihnen gelösten Alizarinfarbstoffes, der zu den Teerfarben gehört. Außerdem aber enthalten sie Eisenverbindungen und Gallussäure, die beide zunächst farblos sind, aber im Laufe weniger Tage eine tiefschwarze und in Wasser unlösliche Verbindung eingehen. Läßt man dem Tintenfleck dazu in dem Gewebe Zeit, so ist er nachher auch mit den besten Wäschemitteln nicht mehr zu entfernen.
Auch für Obstflecke aller Art gilt die gleiche Regel, den Fleck so schnell wie möglich und so gründlich wie möglich mit Wasser auszuwaschen. Der alte Brauch, auf Obst- und Weinflecke sofort etwas Tischsalz NaCl zu streuen, ist ziemlich zwecklos, da hierdurch keine Veränderung oder Verbesserung bewirkt wird. Wirkungsvoller ist ein Bleichen des bestmöglich ausgewaschenen Fleckes durch schweflige Säure. Man zündet in einer feuerfesten Schale ein wenig Schwefel an. Er verbrennt unter Bildung der bekannten, zum Husten reizenden Dämpfe. Diese, von der Form SO2, sind das Anhydrid der schwefligen Säure. Sobald sie mit Wasser in Berührung kommen, bilden sie mit diesem schweflige Säure H2SO4. Die schweflige Säure hat aber die besondere Eigenschaft, fast alle roten Pflanzenfarbstoffe zu bleichen.
Man kann dies sehr schön demonstrieren, wenn man eine Schale mit brennendem Schwefel und irgendeine rote Blume unter eine Glasglocke bringt. In wenigen Stunden ist dann aus einer roten Rose eine weiße geworden.

Fig. 146.
Die bleichende Kraft der schwefligen Säure.
Unter eine Glasglocke bringt man ein wenig angezündeten Schwefel und eine rote Rose. Der brennende Schwefel liefert schweflige Säure, welche die Blume in kurzer Zeit stark bleicht, da ihr roter Farbstoff durch die Säure zerstört wird.
Auch bei roten Obstflecken tut die schweflige Säure ihre Wirkung, hält man die nasse gewaschene Stelle über die Schwefeldämpfe, so verschwinden sehr bald die letzten roten Spuren. Dann aber muß sofort wieder energisch gewaschen und mit Sodalauge nochgespült werden, denn ebenso wie die Schwefelsäure tut auch die schweflige Säure der Zellulosefaser auf die Dauer nicht gut.
In der Küche machen wir im Lauf der Zeit an unseren Kochtöpfen und insbesondere am Teekessel eine unliebsame Entdeckung. Der Boden und überhaupt die vom Wasser bedeckten Teile überziehen sich mit einem steinartigen Belag, dem sogenannten Kesselstein, der von Monat zu Monat stärker wird und den Kessel schließlich unbrauchbar macht, hier geschah folgendes: Unser Trinkwasser enthält stets etwas kohlensauren Kalk, dessen Gegenwart die Härte des Wassers bedingt. Im natürlichen kalten Wasser ist der kohlensaure Kalk als Bikarbonat von der Form Ca(HCO3)2 enthalten. Beim Kochen findet eine Aufspaltung des Bikarbonats in gewöhnliches Karbonat CaCO3 und Kohlensäure CO2 sowie Wasser H2O statt.
Das Kalziumkarbonat CaCO3, ist nun aber im Wasser unlöslich, es fällt aus und bildet den genannten Kesselstein. Eine mechanische Entfernung dieses Belages ist nur schwer möglich und führt gewöhnlich zu Beschädigungen des Kessels oder doch wenigstens des Emailleüberzugs. Wohl aber können wir den Kesselstein auf chemischem Wege schnell und sicher entfernen. Wir gießen eine Lösung von verdünnter Salzsäure in den Kessel und merken alsbald, daß der Kesselstein an allen Stellen, wo ihn die Lösung berührt, kräftig aufzubrausen beginnt. Es findet hier eine chemische Umsetzung zwischen je einem Molekül des Kalziumkarbonats und je zwei Molekülen der Salzsäure nach der folgenden Gleichung statt; CaCO3 + 2HCl = CaCl2 + OH2 + CO2. Es bildet sich also Wasser, welches in der Lösung bleibt, Kohlensäure CO2, welche gasförmig wegsprudelt, und Chlorkalzium, welches in recht großen Mengen leicht in Lösung geht.
Nach geraumer Zeit hört die Gasentwicklung auf. Man wird jetzt die Flüssigkeit aus dem Kessel fortgießen und nach Bedarf eine neue Portion verdünnter Salzsäure hineingeben. Nach genügender Wiederholung dieses Verfahrens wird der Kessel in seinem Inneren vollkommen sauber und von jeder Spur von Kesselstein befreit sein. Das Verfahren ist überaus einfach, sofern man es mit emailliertem Geschirr zu tun hat, das selbst von der Säure nicht angegriffen wird. Dagegen ist bei metallischen Gefäßen und namentlich bei Aluminiumgeschirr Vorsicht am Platze, da auch Aluminium von der Salzsäure angegriffen wird. Es empfiehlt sich hier, jedesmal vor dem Einbringen neuer Säure die bereits vom Kesselstein befreiten und wieder blank gewordenen Stellen trocken zu reiben und mit einem Fett, etwa Schmalz oder Butter, zu beschmieren, welches das Metall gegen den Angriff der Säure schützt.
Die Salzsäure findet auch noch anderweitig im Haushalt und im täglichen Leben Verwendung. Wir benutzen sie bei allen Lötarbeiten, und wo würde in unserer Radiozeit nicht gelötet! Das Weichlöten, d. h. das Löten mit Zinn, ist in der Tat eine einfache und leicht zu erlernende Handfertigkeit, aber man darf dabei gewisse chemische Gesetze und Forderungen nicht aus der Hand lassen.
Das Lötmittel ist, wie gesagt, das Zinn, ein Metall, welches bereits bei 225 Grad schmilzt. Es besitzt die Eigenschaft, in gut flüssigem Zustande, also bei einer Temperatur von etwa 300 Grad, an anderen, vollkommen reinen Metallen zu haften, deren Oberfläche also zu benetzen, wie etwa Seifenwasser eine Glasplatte benetzt. Außerdem findet dabei eine oberflächliche Legierung des flüssigen Zinns mit den zu verlötenden Metallen statt. Lötet man beispielsweise zwei Kupferstücke mit Zinn zusammen, so löst sich auf diesen Stücken eine freilich äußerst feine Kupferschicht in dem Zinn, obwohl der Schmelzpunkt des Kupfers mit 900 Grad Celsius weit über der Temperatur des flüssigen Lötzinns liegt. Nach dem Erstarren sind die beiden Stücke dann sehr fest verbunden, da durch den Lötprozeß ein sehr enger molekularer Zusammenhang bewirkt wurde.
Um aber eine solche Lötung gut auszuführen, sind mancherlei chemische Mittel notwendig (Fig. 147).

Fig. 147.
Die Kunst des Lötens.
Zum Löten gehört ein heißer und an der Spitze gut verzinnter Kupferkolben, Lötwasser (Chlorzink), Salzsäure (Chlorwasserstoff), ein Lötstein (Chlorammonium) und Lötzink. Die zu lötenden Stellen müssen mechanisch durch Schaben und Kratzen und weiter chemisch durch Bepinseln mit Lötwasser oder Salzsäure von allen Verunreinigungen befreit werden.
Wir brauchen erstens eine gewisse Menge Salzsäure von der Form HCl. Ferner eine Portion Lötwasser oder Zinkchlorid von der Form ZnCl2. Dies Lötwasser stellen wir uns selbst her, indem wir etwa in einen halb mit Salzsäure gefüllten Tassenkopf einige Stücke Zinkblech werfen. Die Säure beginnt alsbald kräftig aufzubrausen und erwärmt sich nicht unbeträchtlich, während Wasserstoff entweicht. Es findet dabei eine Umsetzung statt, indem das Zink aus der Salzsäure den Wasserstoff verdrängt und sich mit zwei Chloratomen zu Zinkchlorid vereinigt. Da der entweichende Wasserstoff stets Säuredämpfe mitreißt, bereitet man sich das Lötwasser am besten im Freien. Außer den beiden genannten Flüssigkeiten benötigt man ferner noch den sogenannten Lötstein, d. h. ein etwa faustgroßes Stück Chlorammonium von der Form ClNH4.
Der Lötkolben muß nicht nur genügend heiß, sondern auch gut verzinnt sein. Man erwärmt ihn am besten in der blauen heißen Stichflamme eines Bunsenbrenners oder einer Lötlampe und reibt ihn mit der verzinnten Spitze kräftig auf dem Lötstein unter Hinzugabe eines Tropfens Zinn. Der Lötkolben hat die genügende Temperatur, wenn sich seine verzinnte Spitze an der Luft mit einem gelblich schimmernden Häutchen überzieht. Während man den Kolben nun auf der Flamme läßt, hat eine gründliche Reinigung der zu lötenden Stellen zu erfolgen. Sind diese ganz grob durch Rost oder starke Oxydschichten, Ölfarbenflecke oder dergleichen verunreinigt, so muß zunächst eine mechanische Reinigung mit Feile, Schaber, stählerner Kratzbürste oder ähnlichen Mitteln erfolgen, durch welche die groben Verunreinigungen entfernt werden und der blanke Metallgrund zutage tritt.
Aber man würde trotz dieser Reinigung nicht zum Ziel gelangen, wenn man jetzt etwa ohne die genannten Lötmittel löten wollte. Denn alle unedlen Metalle, wie Kupfer, Zink, Messing und dergleichen, überziehen sich an der Luft sofort wieder mit einer Oxydschicht, die zwar zunächst noch unsichtbar fein ist, aber den Lötprozeß doch schon hindern würde. Sobald aber der heiße Kolben an die Stücke kommt, würde dieser Oxydationsvorgang noch viel schneller vonstatten gehen und erst recht jede Lötung vereiteln. Es ist daher unbedingt notwendig, die mechanisch gereinigten Stücke sofort mit der Lötflüssigkeit einzupinseln, handelt es sich um Zinkstücke, so nimmt man dazu reine Salzsäure, die nun sofort aufschäumt, Zinkchlorid bildet und jede Spur etwa noch vorhandenen oder neu gebildeten Zinkoxyds auflöst, so daß unter der Lötflüssigkeit eine chemisch reine Zinkfläche vorhanden ist. Für alle anderen Metalle nimmt man Lötwasser, welches hier in der gleichen Weise oxydlösend und reinigend wirkt.
Man nimmt nun den Lötkolben aus der Flamme, reibt ihn noch einmal auf dem Lötstein und fährt mit seiner verzinnten Spitze über die noch unter einer Schicht Lötflüssigkeit stehenden Metallstellen. War die Reinigung genügend, so verzinnen sich diese im Augenblick, d. h. während die Lötflüssigkeit unter dem Einfluß der Kolbenhitze verdampft, überzieht sich das Metall mit einem weißglänzenden Zinnspiegel. Die beiden zu verbindenden Stücke werden im allgemeinen immer am besten erst einzeln verzinnt, die Verzinnung wird nochmals mit Lötwasser bestrichen, die zu verbindenden Stücke werden in der gewünschten Lage mit einer passenden Zange zusammengepreßt und mit dem heißen, gut verzinnten und gereinigten Kolben erhitzt, so daß das Zinn auf der ganzen Lötstelle zum Fließen kommt.
Nach der Wegnahme des Kolbens sind sie mit der Zange so lange zusammengepreßt zu halten, bis das Zinn vollkommen erstarrt ist. Darauf hat eine gründliche Waschung der Lötstelle zu folgen, durch die jede Spur von Säure entfernt wird. Am besten benutzt man Sodalauge, durch welche die Säure neutralisiert wird.
Für das Löten gilt der Grundsatz, daß mit einem kalten Kolben auch der Meister nicht löten kann, daß aber unreine, nicht genügend gesäuberte und mit den Lötmitteln behandelte Stücke auch mit dem heißesten Kolben niemand zu löten vermag. Das Zinn rollt in kleinen Kügelchen auf ihnen umher wie Quecksilber auf einer Glasplatte, aber es findet keinerlei Benetzung der Flächen mit dem Zinn, keine Legierung, überhaupt kein Lötprozeß statt.
Es ist bei solchen Lötarbeiten kaum zu vermeiden, daß die Finger des Lötenden mit Salzsäure oder Lötwasser befleckt werden. Man stellt sich deshalb vorteilhafterweise ein Gefäß mit Sodalauge zurecht, spült die Hände öfters mit reinem Wasser und steckt sie dann in die Lauge. Grundsätzlich verkehrt ist es, die Hände sofort einzuseifen. Man erlebt dabei die unangenehme Überraschung, daß sich an den mit der Säure befleckten Hautstellen häßliche schwarze Flecke zeigen, die bisweilen erst nach Tagen verschwinden. Die Seife tritt mit dem Zinkchlorid in eine chemische Wechselwirkung, bei der eine dunkle und im Wasser unlösliche Zinkseife zustande kommt, die eben jene Flecke bildet.
Der Salzsäure sei schließlich noch als eines Hausmittels gedacht. Man gibt 5–10 Tropfen reiner Salzsäure auf ein Weinglas voll Wasser als Verdauungsmittel. Während man aber für Lötzwecke die gewöhnliche Salzsäure vom Drogisten nehmen kann, muß man für diesen medizinischen Zweck unbedingt die chemisch reine Salzsäure der Apotheke wählen, denn die gewöhnliche Salzsäure besitzt fast immer Verunreinigungen, wie Arsen und dergleichen, die zwar beim Löten nicht stören, aber für den innerlichen Gebrauch unter allen Umständen zu meiden sind.
Es wurde bereits gesagt, daß der menschliche Organismus ein äußerst kunstvoller chemischer Apparat ist. Greifen wir nun den Verdauungstraktus heraus, so finden wir bereits Beweise für diese Behauptung. Die Vorgänge der Verdauung oder Nahrungsmittelverarbeitung spielen sich in drei Stationen, nämlich im Munde, im Magen und im Darm ab. Die Vorgänge im Munde sollen rein basischer Natur, diejenigen im Magen saurer Natur und diejenigen im Darm wieder basischer Natur sein.
Im Munde findet der Prozeß des Kauens und Einspeichelns der Speisen statt. Das Einspeicheln erfolgt rein automatisch, wenn die Kaumuskulatur kräftig arbeitet. Ähnlich wie bei der Giftschlange der bloße Druck des Bisses die Giftdrüsen zur Entleerung bringt, so werden durch den Muskeldruck beim Kauen die Speicheldrüsen zu kräftiger Absonderung gezwungen. Der Speichel ist basischer Natur, d. h. er bläut rotes Lackmuspapier. Außerdem entwickelt er eine Fermentwirkung auf alle Stärkemehl haltigen Speisen, wie Kartoffeln, Brot und dergleichen. Er verwandelt sie während des Kauens bereits zum großen Teile in zuckerartige Verbindungen, die der weiteren chemischen Verarbeitung im Magen viel leichter zugänglich sind als die reine Stärke. Aber auch die eiweißhaltige Nahrung wird bereits durch das Einspeicheln chemisch verändert. Es bilden sich Verbindungen der Eiweiße oder Albuminate mit dem Alkali des Speichels, die sogenannten Alkalialbuminate, welche nun in Salzsäure und salzsäureähnlichen Verbindungen komplizierterer Art, zu denen der Magensaft oder das Pepsin gehören, leicht löslich sind.
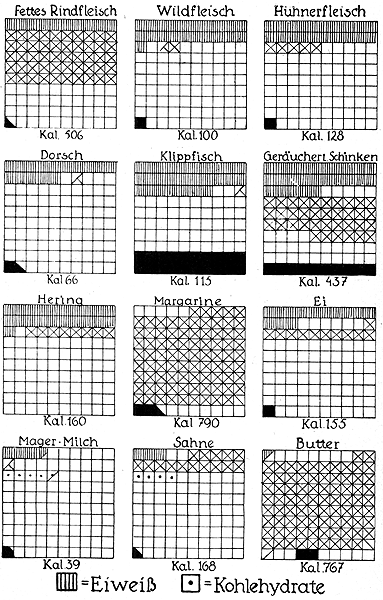
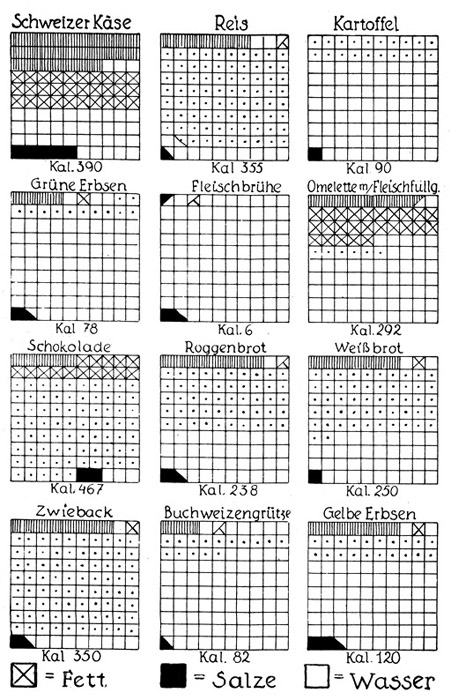
Fig. 148 und 149.
Die Zusammensetzung unserer wichtigsten Nahrungsmittel.
Jedes der großen Quadrate ist in hundert kleine Quadrate geteilt. Ein kleines Quadrat bedeutet also einen Gehalt von je einem Gewichtsprozent. Faßt man die großen Quadrate als Gewichtsmengen von je hundert Gramm auf, so bedeutet jedes kleine Quadrat ein Gramm. Auf die Gewichtsmengen von je hundert Gramm beziehen sich die unter den einzelnen Nahrungsmitteln stehenden Kalorien. Ein Gramm Eiweiß liefert 4,1 Kalorien. Desgleichen ein Gramm Stärke oder Zucker. Ein Gramm Fett gibt 9,3 Kalorien. Der Tagesbedarf eines kräftigen Mannes wird in unseren Breiten zu 3000 Kalorien angenommen, doch scheint diese Zahl nach den Kriegserfahrungen zu hoch zu sein.
In der beschriebenen Weise vorbereitet, verlassen die Speisen die Mundhöhle und gelangen in den Magen, in welchem das Pepsin und außerdem ein ebenfalls saures Ferment der Pankreas- oder Bauchspeicheldrüse die wirkenden Chemikalien sind, hier erfolgt insbesondere die weitere Aufspaltung der Eiweißstoffe, wobei die so ungemein komplizierten Eiweißmoleküle in einfachere Verbindungen, die Peptone, zerlegt werden. Der gesamte Magenprozeß ist sauer. Es können nun zwei Möglichkeiten vorkommen. Der Säuregehalt des Magens kann zu gering sein, die Pepsinabsonderung aus irgendwelchen Gründen nicht ausreichen. In diesem Falle wird durch ein wenig Salzsäure, wie bereits ausgeführt, der nötige Säuregehalt hergestellt. Es kann aber auch andererseits der Säuregehalt zu groß sein, mag nun der Magen allzu stark Säure absondern, oder mag sie durch allzu saure Speisen in ihn hineingelangt sein. In diesem Falle ist es erwünscht, den Säureüberschuß zu neutralisieren, und die gebräuchlichen Mittel dafür sind die gebrannte Magnesia von der Form MgO oder das doppeltkohlensaure Natron von der Form NaHCO3. Beide Verbindungen neutralisieren die freie Salzsäure des Magens, bilden mit ihr ein neutrales Salz, während aus dem Natron Kohlensäure frei wird, die das bekannte Aufstoßen nach diesem Mittel zur Folge hat.
Vom Magen geht es in den Darm, und hier ist besonders die Rolle, welche die Galle spielt, interessant. Die Galle bewirkt besonders die Verdauung der Fette, d. h. ihren Abbau auf einfachere Atomgruppen. Um die Fette dem Verdauungsprozeß unterwerfen zu können, müssen sie in eine wasserlösliche Form gebracht werden, und dies ist eine der ersten Aufgaben der von der Galle abgesonderten und in den Darm geleiteten Gallensäfte, hält man sich diese Eigentümlichkeit der Galle vor Augen, so leuchtet es wohl ein, warum man Ochsengalle als ein wertvolles Waschmittel verwendet. Sie besitzt eben die Fähigkeit, alle Fette in wasserlöslichen Zustand zu bringen, und entfernt daher alle Fettflecke aus den zu säubernden Stücken gründlich, schnell und unter vollkommener Schonung der Fasern sowohl als auch der Farbe des zu reinigenden Gewebes. Auch überall sonst in der Technik, wo es sich um die Wasserlöslichmachung von Fettstoffen handelt, beispielsweise bei der Herstellung von Farben und Salben, spielt die Ochsengalle eine beträchtliche Rolle. Im Darmkanal bringt die Galle die Fettstoffe in eine wäßrige Lösung, die nun von den Darmwänden resorbiert und dem Säftestrom des menschlichen Körpers zugeführt werden kann.
Wir sahen, daß der menschliche Organismus wie eine chemische Fabrik arbeitet. Für das gute Funktionieren dieser Fabrik wird naturgemäß die Art der ihm zugeführten Betriebsstoffe, d. h. der Nahrungsmittel, von großem Einfluß sein (Fig. 148 u. 149). Dabei müssen wir zunächst zwei wichtige Eigenschaften eines jeden Nahrungsmittels unterscheiden, nämlich seinen Nährwert und seine Verdaulichkeit. Diese beiden Eigenschaften bestehen vollkommen unabhängig voneinander. Wir haben Nahrungsmittel, wie beispielsweise hartgekochte Eier, die zwar einen recht beträchtlichen Nährwert besitzen, aber schwer verdaulich sind, während andere, wie beispielsweise frische Austern, sich zwar durch leichte Verdaulichkeit, aber geringen Nährwert auszeichnen.
Es ist die Aufgabe der Küche, die rohen Nahrungsmittel mit ihrem gegebenen Nährstoffgehalt durch die Zubereitung noch aufzuschließen und in besonders leicht verdauliche Formen zu bringen. Dabei spielen aber nicht nur die durch das Kochen, Braten oder Backen wirklich hervorgerufenen chemischen Umwandlungen, sondern auch das Aussehen, der Geruch und Geschmack der fertig zubereiteten Speisen eine wichtige Rolle. Nicht umsonst sagt man, daß einem bei dem Geruch eines leckeren Bratens das Wasser im Munde zusammenläuft. Es ist eine durch Tierversuche experimentell festgestellte Tatsache, daß schon allein durch den Duft gut zubereiteter Speisen die sämtlichen für die Verdauungsarbeit wichtigen Drüsen zu lebhafter Absonderung angeregt werden.
Das beginnt mit den Speicheldrüsen, so daß buchstäblich das »Wasser im Mund zusammenläuft«. Es findet aber ebenso stark auch bei den weiteren Drüsen statt, der Pepsingehalt und Säuregrad der Magenflüssigkeit steigt ebenfalls und bewirkt ein gesteigertes Hungergefühl oder zum mindesten Appetit. Ein leckeres Aussehen der Speisen unterstützt diese vorbereitende chemische Tätigkeit des menschlichen Organismus noch. Es liegt daher sicherlich richtige Beobachtung in der alten Tantalussage, wo die Qual des Hungers durch den steten Anblick lockender Speisen verschärft wird.
Dagegen wirken Speisen von unangenehmem Geruch und Aussehen geradezu verlangsamend auf die Drüsenabsonderung und werden infolgedessen schlechter verdaut. Auch hier bewahrheitet sich die alte Regel, daß Speisen, die mit Unlust genossen werden, nicht bekommen. Der Volksmund sagt, daß sie vor dem Magen stehen bleiben oder schwer im Magen liegen. Das letztere trifft zu. Da die Magendrüsen nur schwächlich absondern, geht auch die Verdauung nur langsam vonstatten, und eine Speise, die den Magen normalerweise etwa in einer Stunde gut verdaut verlassen könnte, bleibt stundenlang darin liegen. Man sieht wohl, daß die Kochkunst sich in mannigfachster Weise auswirkt, und daß man nicht ohne praktischen Grund von alters her auch großen Wert auf den Geruch und das Aussehen der Speisen gelegt hat. Gewiß ist auch der Geschmack wichtig, aber er beginnt erst zu wirken, wenn die Speisen auf der Zunge liegen, während die anderen Eigenschaften sich weit früher bemerkbar machen. So ist die Kochkunst recht eigentlich die angewandte Chemie des täglichen Lebens.
Die Rohstoffe, die der Küche zugeführt werden, zeichnen sich durch sehr verschiedene Zusammensetzung aus. Fast allen gemeinsam ist aber der hohe Wassergehalt, der bei einigen überhaupt nur wenige Gewichtsprozente für die eigentlichen Nährstoffe übrig läßt. In der vorstehenden Darstellung (Fig. 148 u. 149) sind die prozentualen Zusammensetzungen der wichtigsten Nahrungsmittel gegeben. Die Zeichnung ist so gewählt, daß eine quadratische Fläche in hundert kleinere Quadrate geteilt wurde, von denen also jedes 1 Prozent bedeutet. Wir finden in dieser Tabelle verschiedene Fleisch- und Fischarten, Speisefette, Eier, Milch und Käse, verschiedene Gebäcke und Früchte. Alle diese Nahrungsmittel sind auf Eiweiß, Zeit, Kohlenhydrate, Mineralstoffe und Wasser analysiert.
Die weißen Quadrate bedeuten Wasser, und so zeigt schon eine oberflächliche Betrachtung sofort den Unterschied zwischen gehaltvolleren und ärmeren Nahrungsmitteln. Aber auch der Gehalt an den drei wichtigsten Komponenten Eiweiß, Fett und Kohlenhydrat spielt eine Rolle. So sehen wir zum Beispiel, daß Roggenbrot und somit auch Roggenmehl immerhin 8 Prozent Pflanzeneiweiß und außerdem 50 Prozent Kohlenhydrat in Form von Stärkemehl enthält, aber kaum ein halbes Prozent Fett. Dagegen ist die Butter durch einen Fettgehalt von 82 Prozent ausgezeichnet, dem nur ein halbes Prozent Eiweiß und ein halbes Prozent Kohlenhydrat gegenübersteht. Aber aus der Zusammensetzung geht hervor, daß eine mit Butter bestrichene Roggenbrotschnitte jedenfalls ein Nahrungsmittel ist, welches die lebenswichtigen Stoffe in der richtigen Verteilung enthält.
Auch der so oft genannte Schmarren der Alpenbewohner, jener einfache, in Fett gebackene Roggenmehlkuchen, bietet diese günstige Zusammensetzung, und es leuchtet wohl ein, daß man bei dieser Nahrung das eiweißreiche Fleisch fast vollkommen entbehren kann. Sehr hochwertige Nahrungsmittel sind nach der gegebenen Zusammenstellung auch Zwieback und Schokolade, der erstere mit nur 15 Prozent, die letztere mit nur 3 Prozent Wassergehalt.
Der hohe Gehalt an Nährstoffen kommt auch in den unter den einzelnen Stoffen angegebenen Kalorien zum Ausdruck. Eine Kalorie ist ja bekanntlich diejenige Wärmemenge, welche hinreicht, um 1 Kilogramm Wasser um 1 Grad Celsius zu erwärmen. Es ist nun bei jedem Nahrungsmittel angegeben, wieviel Kalorien 100 Gramm davon im menschlichen Körper freimachen. Da finden wir die höchste Zahl von 790 Kalorien bei der Margarine, während die Zahlen bei Fleisch und Fisch erheblich geringer sind. Die Kunst der Küche besteht darin, die Rohstoffe für die Mahlzeiten so zusammenzustellen, daß einerseits genügend Eiweiß vorhanden ist und andererseits die für den Organismus notwendige tägliche Kalorienmenge erreicht wird. Vor dem Weltkriege nahm man für einen mittelschwer arbeitenden Mann einen täglichen Bedarf von 3000 Kalorien an und kam dementsprechend auf recht bedeutende Mengen von Nahrungsmitteln. Die Erfahrungen der Hungerjahre haben aber gezeigt, daß diese Aufstellung falsch war, und daß eine beträchtlich geringere Kalorienmenge vollkommen hinreicht, um den Organismus in gutem Zustande zu erhalten.
Auch die Nahrungsmittelchemie ist noch in regem Fortschreiten begriffen. Schon heute wissen wir, daß die hier gegebene Einteilung in Eiweiß, Fett und Kohlenhydrate nur roh ist, und daß einige ganz bestimmte Stoffe von eiweißartiger Natur, die sogenannten Vitamine oder Lebensstoffe, eine ganz besondere Rolle spielen. Fehlen diese, so hilft auch die gehaltreichste Nahrung nicht.

Fig. 150.
Die Nahrungsmittelfabrik der Zukunft.
Aus den beiden Rohstoffen Kohlenstoff und Wasser werden unter Hinzufügung einer gewissen Energiemenge nahrhafte Kohlenhydrate, wie Stärkemehl, Dextrin und Zucker, hergestellt.
Ein Beispiel dafür bietet die früher allgemein übliche Schiffskost aus Pökelfleisch, Zwieback und Erbsen, die gewiß recht gehaltvoll ist und trotzdem sehr bald zum tödlichen Skorbut führt, weil die Vitamine frischer grüner Pflanzen dabei fehlen. Es ist erstaunlich, wie sehr winzige Mengen dieser Vitamine im Betrage von Bruchteilen eines Milligramms das Wohlbefinden, ja das Leben des Menschen und auch der Tiere zu beeinflussen vermögen. Die Chemie unserer Tage ist an der Arbeit, diese Vitamine, von denen man heute bereits drei verschiedene Gruppen kennt, genau zu erforschen und isoliert darzustellen. Auch auf dem Gebiet der Nahrungsmittelchemie dringen wir immer tiefer in die Zusammenhänge ein und finden vieles bestätigt, was früher rein erfahrungsmäßig geübt wurde. Vielleicht ist die Zeit nicht mehr allzu fern, in der wir den Ackerpflanzen einen Teil der Arbeit abnehmen und wenigstens die Kohlenhydrate in der Nahrungsmittelfabrik unmittelbar aus Kohlenstoff und Wasser, bzw. Wasser und Kohlensäure herstellen (Fig. 150). Theoretisch liegt das jedenfalls nicht mehr außer dem Bereich der Möglichkeit, und es ist nur eine Frage der Zeit, wann einmal die Praxis sich diese Möglichkeit zunutze machen wird.