
|
||||||||||||||
| Autoren | ∞ | Werke | ∞ | Neu | ∞ | Information | ∞ | Shop | ∞ | Lesetips | ∞ | Textquelle | ∞ | |
Anzeige. Gutenberg Edition 16. 2. vermehrte und verbesserte Auflage. Alle Werke aus dem Projekt Gutenberg-DE. Mit zusätzlichen E-Books. Eine einmalige Bibliothek. +++ Information und Bestellung in unserem Shop +++
Die chemischen Vorgänge sind nun bestimmten und zum großen Teil bereits genau bekannten Gesetzen unterworfen. Über diese Gesetze werden wir uns zunächst einen allgemeinen Überblick zu verschaffen haben, um die besondern chemischen Vorgänge zu verstehen, die im Innern der Pflanzenkörper vor sich gehen.
Wenn wir uns in der Welt umsehen, so finden wir, daß diese aus überaus verschiedenartigen einzelnen Stücken zusammengesetzt ist, welche die Gesamtheit der wägbaren Körper darstellen. Unser eigner Körper bildet ein solches Stück in seiner Umgebung, und alle die Objekte, mit denen wir unaufhörlich zu tun haben, von denen unser Leben und unsere Tätigkeit abhängt, bilden ebenfalls einzelne derartige Stücke. So der Bleistift, den ich in der Hand habe und mit dem ich diese Worte schreibe, so das Papier, auf welchem der Text geschrieben wird, so hernach die Lettern, die der Setzer zusammenstellt, und ebenso zum Schluß das Buch, das der Leser in der Hand hält und aus dem er diese Dinge liest.
Diese verschiedenen Stücke oder Körper kann man unter verschiedenartigen Gesichtspunkten betrachten. Wo der eine Beschauer sagt: dies ist ja ein Stück von einer antiken Säule, sagt der andere: dies ist ja ein Zylinder und der dritte: dies ist ja Kalziumkarbonat. Der erste ist ein Archäolog, der zweite ein Geometer, der dritte ein Chemiker. Der erste betrachtet das Stück als ein Produkt menschlicher Tätigkeit und sucht zu beurteilen, aus welcher Zeit der Kulturgeschichte der Menschheit dies künstliche Produkt herrührt. Der zweite betrachtet die äußere Gestalt des Stückes und ordnet sie einer der verschiedenen Typen unter, unter denen die Geometrie die regelmäßigen Gestalten zusammenzufassen und zu betrachten lehrt. Der dritte endlich betrachtet das Stück als einen Stoff, d. h. er fragt sich nicht: woher rührt es und welche äußere Gestalt hat man ihm gegeben, sondern er fragt: welche besonderen Eigenschaften oder welche Arteigenschaften hat dieses Stück. Besondere oder Arteigenschaften sind solche, daß jedes einzelne Stückchen von dem ganzen Gegenstand eben diese Eigenschaften aufweist. So wird er sagen: Das ist ein weißer Stoff, mit schimmernder Oberfläche, der nicht allzu hart ist, der sich deshalb leicht zerbrechen läßt, von dem die einzelnen Stückchen, wenn man sie mit Salzsäure übergießt, aufbrausen, d. h. eine Gasentwicklung zeigen, wobei sie sich auflösen. Diese und noch zahllose andere Eigenschaften hat offenbar jedes Teilchen eines solchen Körpers und um solche Eigenschaften handelt es sich, wenn der Chemiker einen Körper der Außenwelt als einen bestimmten »Stoff« anspricht. Wir haben solche Eigenschaften Arteigenschaften genannt und sagen deshalb: die Chemie hat es mit den Körpern zu tun, insofern ihre Arteigenschaften in Frage kommen, und sie nennt in diesem Sinne die Körper: Stoffe.
Nun können die Körper entweder von solcher Beschaffenheit sein, daß sie an jeder beliebigen Stelle und in jedem beliebigen Stückchen gleiche Arteigenschaften aufweisen, wie etwa jenes Stück Kalziumkarbonat, von welchem vorher die Rede gewesen ist. Oder aber sie können von solcher Beschaffenheit sein, daß sie an verschiedenen Stellen verschiedene Arteigenschaften zeigen, wie sich das z. B. meist ergibt, wenn wir irgendeinen Stein von der Erde aufheben und genau betrachten. In den meisten Fällen erweist sich nämlich, daß er aus Stückchen von recht verschiedenartigem Aussehen besteht. Es gibt allerdings auch Steine von gleichteiliger oder homogener Beschaffenheit, wie beispielsweise weißer Marmor oder Quarz.
Wir überzeugen uns ferner sehr bald, daß jene ungleichteiligen Steine nichts sind als Massen, die aus zwei, drei, vielleicht noch mehr Arten bestimmter, gleichteiliger Stoffe bestehen, welche man auf mechanischem Wege voneinander sondern kann. Man stelle sich vor, daß man einen derartigen Stein in lauter so kleine Stückchen zerbricht, daß jedes Stück nur von einer Art Stoff gebildet wird. Man sammle nun etwa alle schwarzen Stückchen zueinander, ebenso alle roten und alle gelben, alle blanken und alle matten Stückchen, so daß aus jeder Art des Stoffes, den man in solch einem Gemenge antrifft, gemäß seinen Arteigenschaften, ein Häufchen für sich gemacht wird. Man hat dann an Stelle des Gemenges, das anfänglich in unserer Hand war, eine Anzahl von verschiedenartigen gleichteiligen Stoffen gewonnen. Denn jedes Häufchen wird von Körperchen gebildet, die untereinander durchaus übereinstimmende Arteigenschaften besitzen, also durchaus das darstellen, was wir einen Stoff nennen.
Dieser Vorgang, den wir eben in Gedanken ausgeführt haben, ist die allereinfachste Form der Zerlegung oder Analyse. Er bedeutet zunächst allerdings noch keine chemische, sondern eine rein mechanische Trennung der nebeneinander befindlichen Stoffe, die den Erfolg hat, daß aus dem Gemenge lauter einheitliche Stoffe entstehen.
Nun sind die Stoffe aber keineswegs sämtlich, wie bisher stillschweigend vorausgesetzt wurde, feste Stoffe. Es gibt auch Flüssigkeiten, die ebenso gekennzeichnet sind, indem nämlich jede besondere Art Flüssigkeit auch ihre besonderen Arteigenschaften hat, die nur ihr zukommen und anderen Arten von Flüssigkeiten nicht. So hat das flüssige Wasser ein anderes Aussehen, einen andern Geschmack, eine andere Dichte, als das flüssige Quecksilber oder der flüssige Weingeist, und man kann also offenbar bei den flüssigen Stoffen ebenso verschiedene Arten unterscheiden, wie wir das eben bei den festen Stoffen getan haben.
Und in dritter Linie gibt es noch gasförmige Stoffe. Sie fallen nicht in die Augen und deshalb hat es lange gedauert, bis man sich von ihrer Existenz eine klare Vorstellung gemacht hat, bis man sie als eine Stoffklasse aufzufassen gelernt hat, die durchaus vergleichbar ist den festen und den flüssigen Stoffen. Gegenwärtig, wo z. B. das Leuchtgas ein regelmäßiger Bestandteil unseres täglichen Lebens geworden ist, haben wir uns daran gewöhnt, die verschiedenen Gase als verschiedene Stoffe zu unterscheiden. Daß aber dieser Unterschied nicht so leicht zu machen war, wie bei Flüssigkeiten oder gar bei festen Körpern, wird anschaulich, wenn wir etwa einen Hahn an der Gasleitung öffnen, wir können durchaus nichts Besonderes sehen, etwa wie wir das Wasser sehen, das aus dem geöffneten Hahn der Wasserleitung ausfließt. Durch ganz bestimmte, keineswegs einfache Einrichtungen kann man allerdings ein solches Ausströmen eines Gases sichtbar machen, aber gerade die verwickelte Beschaffenheit der erforderlichen Versuchsanordnung zeigt, wie schwierig es ist, Gase zu Gesicht zu bekommen. So erklärt es sich denn auch, warum es in der Geschichte der Chemie so lange gedauert hat, bis man die Gase als eine eigene Art von Stoffen erkannt hat, und weshalb auch noch gegenwärtig der Laie einen gewissen Widerspruch empfindet, wenn man von Gasen als Körpern und Stoffen spricht. Da sie indessen stets einen gewissen Raum einnehmen (der allerdings meist von festen oder flüssigen Körpern begrenzt ist) und auch stets ein gewisses, wenn auch verhältnismäßig geringes Gewicht haben, so haben sie auch Anspruch darauf, Körper und Stoffe genannt zu werden, denn die beiden ebengenannten Kennzeichen bilden die Definition der Körper und Stoffe.
Nun können wir diese Stoffe, feste wie flüssige und gasförmige, vielfach in andere mit anderen Arteigenschaften verwandeln. Die einfachsten derartigen Vorgänge erkennt man beispielsweise am Wasser, welches bei Kälte in einen festen Stoff, nämlich das Eis, übergeht, während es in der Hitze sich in einen gasförmigen Stoff, den Wasserdampf, verwandelt. Hier verschwindet also das flüssige Wasser und an seiner Stelle tritt einerseits ein fester Stoff, andererseits ein gasförmiger Stoff auf. Wir haben es mit chemischen Vorgängen zu tun, und zwar mit chemischen Vorgängen allereinfachster Art, so einfachen, daß es lange Zeit gedauert hat, bis man sich entschloß, sie überhaupt als chemische Vorgänge aufzufassen. In jüngster Zeit ist man indessen darüber klar geworden, daß die besonderen Gesetze, denen diese Umwandlungen unterliegen, insofern allgemeiner Natur sind, als sie die einfachsten Fälle der allgemeinen Gesetze darstellen, welche für die zweifellos chemischen Vorgänge gültig sind, so daß man tatsächlich am besten tut, sie den chemischen Vorgängen anzureihen.
Ebenso wie man das flüssige Wasser durch Erniedrigung der Temperatur in festes Eis und durch Erhöhung der Temperatur in gasförmigen Wasserdampf verwandeln kann, verhält es sich mit allen andern Stoffen. Alle Flüssigkeiten erstarren bei einer geeigneten niederen Temperatur und alle Flüssigkeiten sieden oder verwandeln sich in Dampf bei einer geeigneten höheren Temperatur. Dementsprechend wird man auch sagen können und müssen, daß alle festen Körper durch Erhöhung der Temperatur bei irgendeinem bestimmten Wärmegrad schmelzen oder in Flüssigkeit übergehen werden und daß alle gasförmigen Stoffe ihrerseits wiederum bei einer bestimmten niedrigeren Temperatur sich verflüssigen oder in flüssige Stoffe übergehen werden. Seit man in den letzten Jahrzehnten dazu gelangt ist, das Gebiet der Temperaturen sowohl nach unten wie nach oben sehr bedeutend über das bisher erreichte Maß zu erweitern, hat man diese allgemeine Behauptung auch an allen einzelnen Stoffen bewahrheiten können.
Man muß also sagen: Grundsätzlich gesprochen, kann man jede Flüssigkeit in einen festen Stoff, jeden festen Stoff in eine Flüssigkeit, jede Flüssigkeit in ein Gas und jedes Gas in eine Flüssigkeit verwandeln. Und zwar ist die Reihenfolge immer dieselbe. Den tieferen Temperaturen gehören die festen Körper an, dann liegen in den höheren Temperaturen die Flüssigkeiten und in den höchsten die Gase.
In dem letzten Fall bei der Umwandlung von Flüssigkeiten in Gase ist außerdem noch der Druck maßgebend. Je geringer der Druck ist, um so niedriger wird auch die Temperatur sein, bei der eine Flüssigkeit in ein Gas übergeht und umgekehrt.
Endlich ist zu erwähnen, daß, auch die festen Körper sich unmittelbar in Gase verwandeln können, ohne inzwischen in Flüssigkeiten übergegangen zu sein. Dies erfolgt besonders leicht, wenn man den Druck recht niedrig nimmt. Denn da mit der Erniedrigung des Druckes die Temperatur hinuntergeht, bei welcher sich die Stoffe in die Gasform überführen lassen, so kann man durch passende Druckerniedrigung in vielen Fällen die Bedingungen herstellen, daß der bereits feste Körper flüchtig wird, ohne daß man ihn bis zum Schmelzen zu erwärmen braucht. Dann geht natürlich der feste Körper unmittelbar in den Gaszustand über.
An diesen einfachsten chemischen Vorgängen, die man als Änderungen der Formart bezeichnet, stellen wir zunächst einige wichtige und ganz allgemeine Gesetze fest, denen nicht nur die Änderungen der Formart unterliegen, sondern ebenso sämtliche anderen chemischen Vorgänge.
Das erste Gesetz ist das von der Erhaltung des Gewichtes. Als man vor hundert Jahren lebhaft darüber diskutierte, ob die Wärme ein »Stoff« sei oder irgend etwas anderes, führte ein Forscher ( Rumford) folgenden Versuch aus: Er ließ in einer Flasche eine bestimmte Menge Wasser gefrieren und wog dieses Eis so genau als möglich auf einer feinen Wage. Dann stellte er die Flasche in die Wärme und ließ, alles Eis flüssig werden. Man wußte damals bereits, daß dabei eine beträchtliche Wärmemenge von dem Eise aufgenommen wird, während es sich in flüssiges Wasser verwandelt. Das Wasser enthielt also nicht nur den Stoff des Eises, das sich in Wasser verwandelt hatte, sondern dazu noch die große Menge Wärme, die das Eis beim Schmelzen aufgenommen hatte. Die Wägung des flüssigen Wassers wurde mit derselben Sorgfalt und Genauigkeit ausgeführt, mit der das Eis gewogen worden war. Es stellte sich heraus daß keine Änderung des Gewichtes durch die Aufnahme der großen Wärmemenge eingetreten war. Rumford schloß daraus, daß die Wärme kein Stoff sein könne, da er als zur Begriffsbestimmung des Stoffes gehörig das Vorhandensein des Gewichts annahm.
Für uns ist dieses Experiment nach anderer Richtung hin wertvoll. Wir schließen daraus, daß mit einer chemischen Umwandlung, wie die, die zwischen Eis und Wasser stattfindet, keine Änderung des Gewichtes verbunden ist.
Die Frage, ob dieses Gesetz nur für solche einfache chemischen Umwandlungen gilt oder für andere auch, läßt sich gleichfalls durch den Versuch beantworten. Der vor kurzem verstorbene ausgezeichnete Chemiker Landolt hat mit einer unermeßlichen Geduld unter Benutzung der allerschärfsten Hilfsmittel der gegenwärtigen Meßtechnik diese Frage in einer mehr als zehnjährigen Versuchsreihe für unsere Zeit endgültig beantwortet.
Er hat nicht die geringste Gewichtsänderung feststellen können, so genau er auch seine Versuche ausführte und so sehr er auch die chemischen Vorgänge veränderte, an denen er seine Versuche angestellt hatte.
Die Messungen wurden dergestalt ausgeführt, daß die Stoffe, welche bei ihrer gegenseitigen Einwirkung chemische Vorgänge hervorbrachten, luftdicht in Glasgefäße eingeschmolzen wurden, die so eingerichtet waren, daß erst bei ihrer Umwendung die vorhandenen Stoffe in Berührung gelangen und aufeinander einwirken konnten. Fig. 1 zeigt ein derartiges Gefäß. Die beiden nach oben gerichteten offenen Röhren dienen zum Einbringen der benutzten Stoffe und wurden nach dem Beschicken sorgfältig luftdicht zugeschmolzen. Zwei nach Raum, Gewicht und Inhalt übereinstimmende derartige Glasgefäße wurden zunächst auf der Wage gegeneinander ausgeglichen, während die Stoffe noch getrennt waren. Dann wurde der eine Apparat umgekehrt, wodurch der chemische Vorgang eintrat und die Gewichte der beiden Apparate wieder verglichen. Dann wurde der zweite Apparat auch noch umgekehrt, so daß auch in ihm der chemische Vorgang stattfand, und wiederum, die Gewichte verglichen. Die allersorgfältigsten Beobachtungen ergaben, daß, nachdem der Gewichtsunterschied zwischen den beiden Gefäßen vor der ersten Wägung ausgeglichen war, hernach bei der zweiten Versuchsreihe und ebenso bei der dritten durchaus keine Veränderung beobachtet werden konnte, daß also kein chemischer Vorgang die Fähigkeit hat, das Gewicht der beteiligten Stoffe irgendwie zu ändern.
Dies ist ein ganz allgemeines Gesetz und wird als das Gesetz von der Erhaltung des Gewichtes in der Wissenschaft bezeichnet.
Eine zweite allgemeine Tatsache, die bei den obenbeschriebenen einfachen Untersuchungen bereits zur Geltung kommt, ist folgende, wenn man Wasser durch Abkühlen in einen festen Stoff, in Eis verwandelt hat und durch die Wärme wiederum einen flüssigen Stoff aus dem Eise herstellt, so bekommt man immer nur wieder Wasser, aber niemals etwa Öl oder Weingeist oder Quecksilber oder eine andere Flüssigkeit. Umgekehrt bekommt man nur aus Wasser Eis und niemals bekommt man aus einem anderen flüssigen Stoffe, der nicht Wasser ist, Eis mit seinen besonderen Arteigenschaften.
Es sind also die feste Form des Stoffes und die flüssige Form, die aus dem festen Stoffe durch Erwärmung entsteht, einander so zugeordnet, daß man immer nur den einen Stoff in den anderen (und rückwärts den anderen in den einen) verwandeln kann, daß man aber niemals durch eine derartige Verwandlung zu einem ganz anderen Stoff gelangt. Es ist das ein anderes Erhaltungsgesetz, das wir später als das Gesetz von der Erhaltung der Elemente kennen lernen werden.
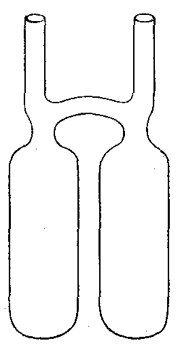
Fig. 1.
Vorläufig entnehmen wir den eben beschriebenen wohlbekannten Tatsachen nur den Schluß, daß die verschiedenen Stoffe, die durch chemische Umwandlung aus einander entstehen können, in einer ganz bestimmten Beziehung zueinander stehen. Sie bilden eine Gruppe von miteinander verwandten oder miteinander zusammenhängenden Stoffen, derart daß, man nur immer ein Glied dieser Gruppe in ein anderes und umgekehrt verwandeln kann, niemals aber aus der einen Gruppe (etwa Eis, Wasser und Wasserdampf) in eine andere Gruppe (etwa festes (Quecksilber, flüssiges Quecksilber und Quecksilberdampf) übergehen kann.